题目内容
【题目】纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:1克碳粉燃烧全部生成CO气体时放出9.2kJ热量,2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________________________________________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢可制取甲醛:
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
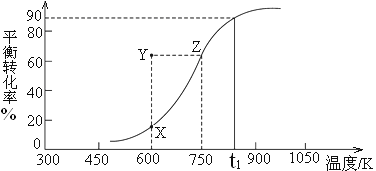
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的υ(正) ____υ(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, t1K时,该反应的平衡常数K=____________。
(3)研究表明,纳米级的Cu2O也可作为太阳光分解水的催化剂。
① 其他条件不变时,若水的分解反应使用Cu2O催化剂与不使用催化剂相比,使用催化剂会使该反应的活化能___________ (填“增大”、“减小”或“不变”),反应热(ΔH)______(填“增大”、“减小”或“不变”)。
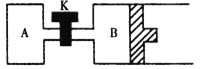
② 如图所示,当关闭K时,向容器A、B中分别充入0.04molH2O(g),起始时V(A) = V(B) = 2L。在一定条件下使水分解(反应过程中温度保持不变,B中活塞可以自由滑动),达到平衡时,V(B) = 2.4L。平衡时,两容器中H2O(g)的分解率A_____________B (填“<”、“=”或“>”)。打开K,过一段时间重新达平衡时,B的体积为____________L。(连通管中气体体积不计)。
【答案】 2CuO(s)+C(s)=CO(g)+Cu2O(s),ΔH =+35.6kJmol-1 > < 缩小体积增大压强 0.05 mol·L-1·min-1 4.05 mol·L-1 减小 不变 < 2.8
【解析】(1)1gC(s)燃烧全部生成CO时放出热量9.2kJ;24gC燃烧生成一氧化碳放热220.8KJ,热化学方程式为:①2C(s)+O2(g)=2CO(g)△H=-220.8kJmol-1;②2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,根据盖斯定律, ![]() (①-②)得:2CuO(s)+C(s)=CO(g)+Cu2O(s),ΔH =
(①-②)得:2CuO(s)+C(s)=CO(g)+Cu2O(s),ΔH =![]() ×[(-220.8kJmol-1)-(–292kJmol-1)]=+35.6kJmol-1,故答案为:2CuO(s)+C(s)=CO(g)+Cu2O(s),ΔH =+35.6kJmol-1;
×[(-220.8kJmol-1)-(–292kJmol-1)]=+35.6kJmol-1,故答案为:2CuO(s)+C(s)=CO(g)+Cu2O(s),ΔH =+35.6kJmol-1;
(2)①根据图像,升高温度,甲醇的平衡转化率增大,说明平衡正向移动,正反应为吸热反应,ΔH>0;600K时,甲醇的转化率小于Y,则Y点反应逆向进行,υ(正)<υ(逆) ,故答案为:>;<;
②要减小甲醇的转化率,可以通过缩小体积增大压强使平衡逆向移动,可以实现从Y点到X点,故答案为:缩小体积增大压强;
③在t1K时,甲醇的平衡转化率为90%,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,平衡时,甲醇的物质的量为0.1mol,则甲醛为0.9mol,氢气为0.9mol,三者浓度分别为0.05mol/L、0.45mol/L、0.45mol/L,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=![]() =0.05 mol·L-1·min-1,t1K时,该反应的平衡常数K=
=0.05 mol·L-1·min-1,t1K时,该反应的平衡常数K=![]() =4.05 mol/L,故答案为:0.05 mol·L-1·min-1;4.05 mol·L-1;
=4.05 mol/L,故答案为:0.05 mol·L-1·min-1;4.05 mol·L-1;
(3)①使用催化剂会降低反应的活化能,但不能改变反应热(ΔH) ,故答案为:减小;不变;
②A为恒温恒容容器,B为恒温恒压容器,随反应进行A容器中压强增大,B容器中为维持恒压,体积增大,平衡正向进行,所以A容器中水的分解率小于B中容器中水的分解率,打开K,过一段时间重新达平衡时,为恒压容器,物质的量之比等于体积之比,平衡后体积为4.8L,B的体积为4.8L-2L=2.8L,故答案为:<;2.8。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
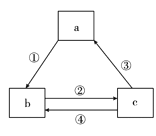
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Na | Na2O | Na2O2 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | C | CO | CO2 | ④条件为高温 |
A. AB. BC. CD. D