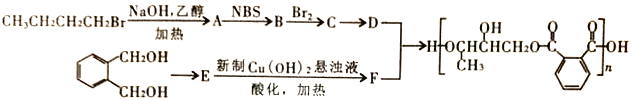
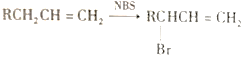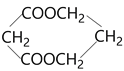题目内容
【题目】(1)标况下5.6L的CO2质量为 _____g,其中含有______个分子,含有_____个原子;
(2)质量均为m g的 HCl、NH3、CO2、O2四种气体,所含分子数目最少的是_________,体积最大的是_____,密度最小的是_______(在相同温度和压强条件下)。
【答案】11 0.25NA 0.75NA CO2 NH3 NH3
【解析】
(1)根据n=![]() 计算二氧化碳物质的量,再根据m=nM计算其质量,根据N=nNA计算分子数目,含有的原子数目为分子数目的3倍;(2)根据n=
计算二氧化碳物质的量,再根据m=nM计算其质量,根据N=nNA计算分子数目,含有的原子数目为分子数目的3倍;(2)根据n=![]() 判断物质的量大小关系,气体的物质的量越大,含有分子数目越大、占有的体积越大;同温同压下,气体的密度之比等于相对分子质量之比;据此分析解答。
判断物质的量大小关系,气体的物质的量越大,含有分子数目越大、占有的体积越大;同温同压下,气体的密度之比等于相对分子质量之比;据此分析解答。
(1)标况下5.6L的CO2的物质的量为![]() =0.25mol,其质量为0.25mol×44g/mol=11g,含有分子数目为0.25mol×NA mol-1=0.25NA,含有原子数目为0.25NA×3=0.75NA,故答案为:11;0.25NA;0.75NA;
=0.25mol,其质量为0.25mol×44g/mol=11g,含有分子数目为0.25mol×NA mol-1=0.25NA,含有原子数目为0.25NA×3=0.75NA,故答案为:11;0.25NA;0.75NA;
(2)质量均为m g的 HCl、NH3、CO2、O2四种气体,M(NH3)<M(O2)<M(HCl)<M(CO2),根据n=![]() 可知:n(NH3)>n(O2)>n(HCl)>n(CO2),所含分子数目最少的是CO2,体积最大的是NH3,同温同压下,气体的密度之比等于相对分子质量之比,故密度最小的是NH3,故答案为:CO2;NH3;NH3。
可知:n(NH3)>n(O2)>n(HCl)>n(CO2),所含分子数目最少的是CO2,体积最大的是NH3,同温同压下,气体的密度之比等于相对分子质量之比,故密度最小的是NH3,故答案为:CO2;NH3;NH3。

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
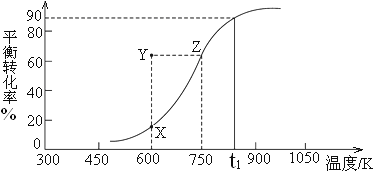
阳光同学一线名师全优好卷系列答案【题目】在温度相同、容积均为2L的三个恒容密闭容器中,按不同方式投入反应物,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molN2、6molH2 | 2molNH3 |
NH3 的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强 | p1 | p2 | p3 |
反应物转化率 |
|
|
|
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. Q3+92.4![]() =92.4 D.
=92.4 D. ![]() <1
<1