题目内容
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度为 mol?L-1;
(2)在标准状况下产生气体的体积为 L。
1 0.448
解析试题分析:Na2SO4+BaCl2=BaSO4↓+2NaCl.n(Na2SO4)=n(BaSO4)=m/M=2.33g÷233g/mol=0.01mol.所以C(Na2SO4)="n÷V=0.01mol÷0.01L=1mol/L." Na2CO3+BaCl2=BaCO3↓+2NaCl. BaCO3+2HCl= BaCl2+H2O +CO2↑.n(BaCO3)=(6.27-2.33)g÷197g/mol=0.02mol.n(CO2)= n(BaCO3)=0.02mol.所以V(CO2)=" 0.02mol×" 22.4L/mol=0.448L.
考点:考查Na2CO3和Na2SO4与BaCl2反应的性质及有关计算的知识。

取20 mL NaOH溶液平均分成两份,分别放入A、B两支试管中。向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下表所示:
| 盐酸体积(单位:mL) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
(1)少量CO2与NaOH溶液反应的离子方程式 ,
过量CO2与NaOH溶液反应的化学方程式 ;
(2)试管A中通入CO2后所得溶液的溶质为 ;
(3)原NaOH溶液的物质的量浓度为 mol/L;
(4)滴加70mL盐酸时,A、B产生CO2的体积均为最大值,则x= mL。
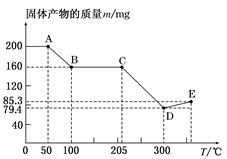
天然碱的组成可以用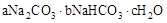 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中: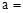
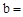

已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
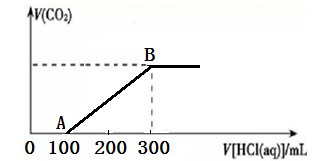
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。