题目内容
强酸和强碱的稀溶液反应的中和热可表示为H+(aq)+ OH- (aq)==== H2O (1);ΔH=-57.3 kJ·mol-1。已知:
CH3COOH(aq)+NaOH(aq)====CH3COONa(aq)+ H2O (1);ΔH=-Q1 kJ·mol-1;
![]() H2SO4 (浓)+NaOH(aq)====
H2SO4 (浓)+NaOH(aq)====![]() Na2SO4 (aq)+ H2O (1);ΔH=-Q2 kJ·mol-1;
Na2SO4 (aq)+ H2O (1);ΔH=-Q2 kJ·mol-1;
HNO3(aq)+KOH(aq)====KNO3(aq)+ H2O (1);ΔH=-Q3 kJ·mol-1。
上述反应均为溶液中的反应,则Q1、Q2、Q3的关系正确的是( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3
C.Q2>Q3>Q1 D.Q2=Q3>Q1
C
【解析】中和热的实质是H+和OH-酸碱中和反应的反应热,因此对于强酸和强碱反应,中和热一般都相等;但是若是有沉淀生成、弱酸或弱碱参与的中和反应等,由于反应中还有溶解热和电离过程的吸热等,这些反应的中和热都不相等。本题中醋酸是弱酸,随着反应的进行,醋酸不断电离出H+,此过程吸热,故醋酸的中和热小于57.3 kJ/mol;浓硫酸稀释过程中要放热,故相关反应热大于57.3kJ/mol。本题容易误选D选项,原因是没有注意到反应2是浓硫酸参与反应。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)═H2O(l);△H=-57.3KJ/mol,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 KJ/mol
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l);△H=-Q2 KJ/mol
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l);△H=-Q3 KJ/mol
则Q1、Q2、Q3的关系正确的是( )
H+(aq)+OH-(aq)═H2O(l);△H=-57.3KJ/mol,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 KJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l);△H=-Q3 KJ/mol
则Q1、Q2、Q3的关系正确的是( )
| A、Q1=Q2=Q3 |
| B、Q2>Q3>Q1 |
| C、Q2>Q1>Q3 |
| D、Q2=Q3>Q1 |
强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ?mol-1,又知在溶液中反应有:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H1=-Q1kJ?mol-1,
H2SO4(浓)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H2=-Q2 kJ?mol-1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3=-Q3 kJ?mol-1,
则△H1、△H2、△H3的关系正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3=-Q3 kJ?mol-1,
则△H1、△H2、△H3的关系正确的是( )
| A、△H1=△H2=△H3 |
| B、△H2>△H1>△H3 |
| C、△H1>△H3>△H2 |
| D、△H2=△H3>△H1 |
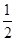 H2SO4(浓)+ NaOH(aq) =
H2SO4(浓)+ NaOH(aq) =  KNO3(aq)+ H2O(l) ; △H = - Q 3 kJ·mol-1,
KNO3(aq)+ H2O(l) ; △H = - Q 3 kJ·mol-1,