题目内容
强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ?mol-1,又知在溶液中反应有:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H1=-Q1kJ?mol-1,
H2SO4(浓)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H2=-Q2 kJ?mol-1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3=-Q3 kJ?mol-1,
则△H1、△H2、△H3的关系正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3=-Q3 kJ?mol-1,
则△H1、△H2、△H3的关系正确的是( )
| A、△H1=△H2=△H3 |
| B、△H2>△H1>△H3 |
| C、△H1>△H3>△H2 |
| D、△H2=△H3>△H1 |
分析:稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水时放热
解答:解:HNO3、KOH为强酸与强碱,其稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O△H3=-57.3kJ/mol,
醋酸的电离吸热,放出的热量小于57.3kJ,则△H1>-57.3kJ/mol,
浓硫酸溶于水时放热放出的热量小于57.3kJ,放出的热量大于57.3kJ,△H2<-57.3kJ/mol,
所以△H1>△H3>△H2
故选D.
醋酸的电离吸热,放出的热量小于57.3kJ,则△H1>-57.3kJ/mol,
浓硫酸溶于水时放热放出的热量小于57.3kJ,放出的热量大于57.3kJ,△H2<-57.3kJ/mol,
所以△H1>△H3>△H2
故选D.
点评:本题考查中和热,明确中和热的概念及弱电解质的电离吸热、浓硫酸溶于水时放热即可解答,难度不大.

练习册系列答案
相关题目
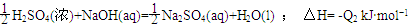
 KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,
KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,