题目内容
能正确表示下列反应的离子方程式是( )
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O |
| B.氯化钠与浓硫酸混合加热:H2SO4+2Cl-△,SO2↑+Cl2↑+H2O |
| C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3—=3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42—恰好完全沉淀:2Ba2++3OH-+Al3++2SO42—=2BaSO4↓+Al(OH)3↓ |
A
解析

练习册系列答案
相关题目
在下列各溶液中,离子一定能大量共存的是
| A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C.含有0.1 mol·L-1 Ca2+溶液在中:Na+、K+、CO32-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:
②常温下,pH=14的溶液中: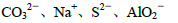
③室温下水电离的
④加入Mg能放出H2的溶液中: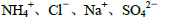
⑤使甲基橙变红的溶液中: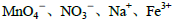
⑥室温下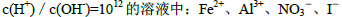
| A.①③⑥ | B.①②⑤ | C.②④⑤ | D.①③④ |
下列物质中,属于电解质的是 ( )
| A.CO2 | B.乙醇 |
| C.Na2SO4 | D.Cl2 |
能正确表示下列反应的离子方程式的是( )
A.新制的氧化铝溶于氢氧化钠溶液:Al2O3+2OH- 2Al 2Al +H2O +H2O |
B.冷的氢氧化钠溶液中通入氯气:Cl2+OH- Cl-+HClO Cl-+HClO |
C.用KIO3氧化酸性溶液中的KI:5I-+I +3H2O +3H2O 3I2+6OH- 3I2+6OH- |
D.硫酸铝溶液中加入过量氨水:Al3++3OH- Al(OH)3↓ Al(OH)3↓ |
某未知溶液中已检验出含大量的Fe2+、SO42—,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH4+、② SiO32—、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
| A.①③⑤ | B.②⑤⑥ | C.①②⑥ | D.③④⑥ |
下列对各组离子或物质是否能够大量共存解释正确的是( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO3—、SO42—、Na+ | 不能共存 | 发生反应:3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O |
| C | 溶液中:K+、Cu2+、Cl-、NH3·H2O | 不能共存 | 发生反应:Cu2++2OH-=Cu(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO42—、HCO3— | 可以共存 | 不能发生反应 |
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验事实,以下推测中正确的是( )
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |
