题目内容
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化汽化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
(2)上述反应中氧化剂是(填化学式)_______________,被氧化的元素是(填元素符号)_____________。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)____________________。
A.氧化性 B.酸性 C.氧化性和酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________升。
(1)3 2K2Cr2O7 8 3CO2 2K2SO4 2 8 (共2分,其中配平1分,化学式1分)
(2)K2Cr2O7 C (各2分)
(3)B (1分)
(4)4.48 (2分)
解析试题分析:(1)由C→CO2、K2Cr2O7→Cr2(SO4)3可知,碳元素的化合价从0价升高到+4价,失去4个电子。Cr元素的化合价从+6价降低到+3价,得到3个电子,所以根据电子得失守恒可知还原剂与氧化剂的物质的量之比是3:2。根据原子守恒可知,反应中还有硫酸钾生成,则反应的化学方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(2)根据(1)可知氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2,被氧化的元素是C。
(3)H2SO4在反应中各元素的化合价没有发生变化,但反应中有硫酸盐生成,所以硫酸只表现酸性,答案选B。
(4)设产生的气体的体积为V,根据反应式计算:
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O转移电子
33.6L 12mol
V 0.8mol
解得V=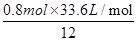 =4.48L
=4.48L
考点:考查氧化还原反应方程式的配平、判断以及有关氧化还原反应的计算

 阅读快车系列答案
阅读快车系列答案过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
某同学为了验证Fe3+是否能氧化H2SO3生成SO,他用50 mL 0.1 mol·L-1 FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42—:_____________________________,
证明Fe3+能够把H2SO3氧化成SO42—。
(2)请完成并配平上述反应中的化学方程式:
2FeCl3+SO2+________===________+H2SO4+________,反应中的氧化产物是________(写化学式)。
(3)吸收液中除了含有H+、Cl-、SO42—以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在________。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:试管、滴管、0.1 mol·L-1KMnO4溶液、0.1 mol·L-1KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3 mL,再用滴管取_________ | 若出现红色,则假设1成立;若未出现红色,则假设1不成立(或假设2成立) |
| 步骤2: | |
| 步骤3: | |
 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O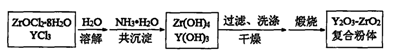
 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(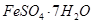 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下: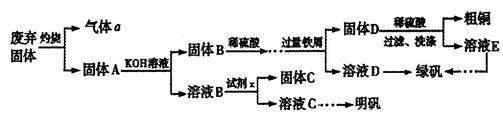

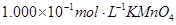 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO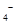 被还原为
被还原为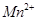 )。
)。