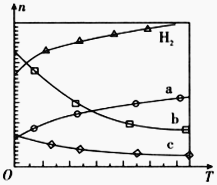
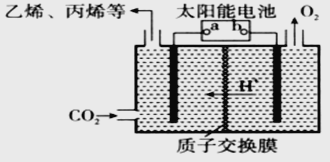
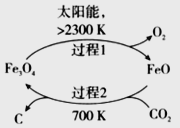
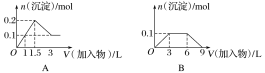
题目内容
【题目】实验室备有质量分数为98%密度为1.84g·cm﹣3的硫酸.据此下列说法正确的是( )
A.该硫酸的物质的量浓度为16.4 molL﹣1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol
C.某同学用该硫酸配制稀硫酸时,未洗涤烧杯和玻璃棒,会造成最终配制的稀硫酸浓度偏低
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 molL﹣1
【答案】C
【解析】
试题分析:A.该硫酸溶液的物质的量浓度为![]() mol/L=18.4mol/L,故A错误;B.50mL该浓硫酸完全反应生成二氧化硫为0.05L×18.4L/mol×
mol/L=18.4mol/L,故A错误;B.50mL该浓硫酸完全反应生成二氧化硫为0.05L×18.4L/mol×![]() =0.46mol,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,实际生成二氧化硫小于0.46mol,故B错误;C.配制稀硫酸时,未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,浓度偏低,故C正确;D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;故选C。
=0.46mol,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,实际生成二氧化硫小于0.46mol,故B错误;C.配制稀硫酸时,未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,浓度偏低,故C正确;D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】为提高资源的利用率,可以将富锰渣(主要成分为Mn、SiO2、Al2O3、Fe)里面的锰再提炼以利用。下图为由富锰渣制备无水氯化锰的工艺流程,回答下列问题:
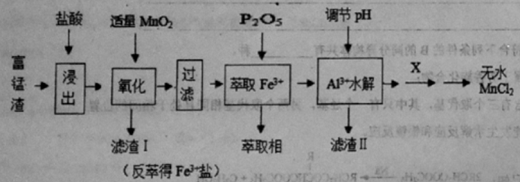
(1)“浸出”前将富锰渣粉碎成细颗粒,其目的是 。
(2)滤渣I的主要成分是 (填化学式)。
(3)加入MnO2氧化时,发生反应的离子方程式为 。
(4)结合下表数据(25℃),应调节pH的范围为 ,从下表中数据计算可得Al(OH)3的溶度积,该温度下Ksp[Al(OH)3]约为 。
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 沉淀开始溶解时的pH |
Al3+ | 4.0 | 5.2 | 7.8 |
Mn2+ | 8.8 | 10.4 | 14 |
(5)已知MnCl2溶液呈弱酸性,操作X为 (填字母序号)。
A.蒸发结晶 B.降温结晶 C.渗析 D.盐析
(6)MnO2的生产方法之一是以惰性电极电解MnCl2和HCl混合溶液,阳极的电极反应是 。