题目内容
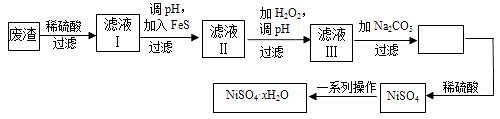
【题目】减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按![]() =1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
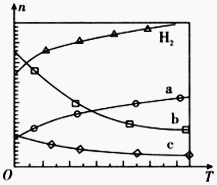
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
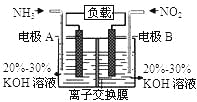
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
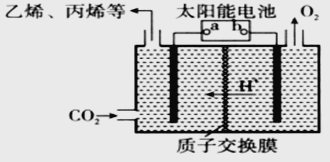
①该工艺中能量转化方式主要有_________。
②b为电源的________(填“正”或“负”)极,电解时,生成乙烯的电极反应式是_________。
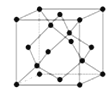
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。
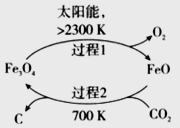
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
【答案】(1)①<(1分) ②H2O(1分) ③加压(或不断分离出水)
(2)①太阳能转化为电能;电能转化为化学能 (2分) ②正(1分) 2CO2+12H++12e-=C2H4+4H2O (2分)
(3)①2mol(2分) ②6FeO+CO2![]() 2Fe3O4+C (2分)
2Fe3O4+C (2分)
【解析】
试题分析:(1)①随着温度升高,氢气的量增加,说明升温平衡逆向移动,所以正反应为放热反应。
②因为反应向逆向移动,所以水和乙烯的量在减少,但是水的量减少的快,所以b为H2O。
③提高转化率,要使平衡正向移动,所以可以加压或不断分离出水。
(2)①太阳能电池是将太阳能转化为电能,电解装置是将电能转化为化学能。
②b极相连的电解池电极附近产生氧气,是溶液中的氢氧根离子失去电子变成氧气,说明电极为正极。电解时二氧化碳得到电子转化为乙烯和水,方程式为2CO2+12H++12e-=C2H4+4H2O;
(3)①2Fe3O4=O2+6FeO,所以每摩尔四氧化三铁反应转移4摩尔电子,所以1mol四氧化三铁反应转移2mol电子。
②从图上分析,氧化亚铁和二氧化碳反应生成了四氧化三铁和碳,方程式为:6FeO+CO2![]() 2Fe3O4+C。
2Fe3O4+C。

 阅读快车系列答案
阅读快车系列答案