题目内容
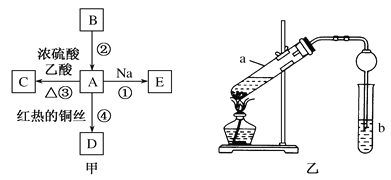
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
【答案】B
【解析】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1D溶液的pH为13(25℃),则D溶液为一元强碱溶液,且其中的金属元素在短周期,则金属元素为Na元素,所以D是NaOH,A和B反应生成强碱,且A和B都是化合物,E是单质,则该反应是过氧化钠和水的反应,所以E是O2,则Z元素是O元素,W的原子序数大于Z,所以W是Na元素;B和C反应生成氧气,两种化合物反应生成氧气的还有过氧化钠和二氧化碳的反应,所以B是Na2O2,则A是H2O,C是CO2,F是Na2CO3,X的原子序数小于Y,则X是H元素,Y是C元素,即X是H、Y是C、Z是O、W是Na元素,A.由X、Y、Z、W四种元素组成的盐是碳酸氢钠,其溶液pH大于7,A错误;B.化合物F是Na2CO3,碳酸钠中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在共价键,所以碳酸钠中含有共价键和离子键,B正确;C.B是Na2O2,C是CO2,在B和C的反应中,氧化剂和还原剂都是过氧化钠,0.1molB与足量C完全反应共转移电子数为0.1NA,C错误;D.Z是O元素,其没有正化合价,D错误;答案选B。

【题目】汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______(用△H1和△H2表示) 平衡常数K3=_____(用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g) ![]() N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(N2O) | n(CO) | n(CO2) | ||
① | 400 | 0.20 | 0.30 | 0.14 |
② | 500 | 0.10 | 0.40 | 0.080 |
③ | 500 | 0.30 | 0.20 | A |
④ | 600 | 0.60 | 0.40 | B |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______。
(3)上述实验编号④达平衡时,b____0.24(填“>”、“<”或“=”),原因是_______。
(4) N2O(g)+C0(g)![]() N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:

①若在第10min仅改变了一个条件,第20min时是在条件下达到新的平衡状态,则第10min 时改变的条件可能是_______;
②比较CO在第5min和第25min时速率的大小v(5)____v(25)(填”>”、“<”或“= ”),你判断的理由是______________。
【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。