题目内容
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化
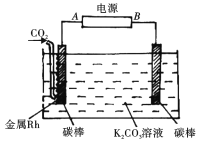
①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285.8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
【答案】C B CO2+ H2O+2e-=CO+2OH- CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1 2.25×104 大
【解析】
(1)所列材料中硅是非常重要的半导体材料,可以用于制造太阳能电池,选C。
(2)由图中信息可知,该装置为电解池,与A相连的电极上发生二氧化碳到一氧化碳的转化,二氧化碳被还原,所以该电极是电解池的阴极, A为电源负极。①电源的正极为B。②因为电解质溶液是呈碱性的碳酸钾溶液,所以阴极发生反应的电极方程式为: CO2+ H2O+2e-=CO+2OH-.
(3)①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285.8kJ/mol、726.5kJ/mol,则有(a)CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol、(b)H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol、(c)CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol,由a+2b-c得,CO(g)+2H2(g)=CH3OH(l) ,所以△H=(-283.0kJ/mol)+2![]() (-285.8kJ/mol)-(-726.5kJ/mol)-128.1kJ·mol-1。所以由CO和H2制备CH3OH(1)的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1。
(-285.8kJ/mol)-(-726.5kJ/mol)-128.1kJ·mol-1。所以由CO和H2制备CH3OH(1)的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g) ![]() CH3OH(g), 由表中数据可知,该反应在30min时达到平衡,平衡时的压强是反应前的40%,所以反应混合物的总物质的量也是反应前的40%.设反应中CO的变化量为x,则H2和CH3OH的变化量分别为2x和x,则(0.1mol-x)+(0.2mol-2x)+x=(0.1mol+0.2mol)
CH3OH(g), 由表中数据可知,该反应在30min时达到平衡,平衡时的压强是反应前的40%,所以反应混合物的总物质的量也是反应前的40%.设反应中CO的变化量为x,则H2和CH3OH的变化量分别为2x和x,则(0.1mol-x)+(0.2mol-2x)+x=(0.1mol+0.2mol)![]() ,解之得,x=0.09mol,则CO、H2、CH3OH的平衡浓度分别为0.01 mol/L、0.02 mol/L、0.09mol/L,所以该温度下的平衡常数K=
,解之得,x=0.09mol,则CO、H2、CH3OH的平衡浓度分别为0.01 mol/L、0.02 mol/L、0.09mol/L,所以该温度下的平衡常数K=![]() 2.25×104。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,根据平衡移动原理可以判断,CH3OH的体积分数比原平衡时大。
2.25×104。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,根据平衡移动原理可以判断,CH3OH的体积分数比原平衡时大。

 名校课堂系列答案
名校课堂系列答案