题目内容
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
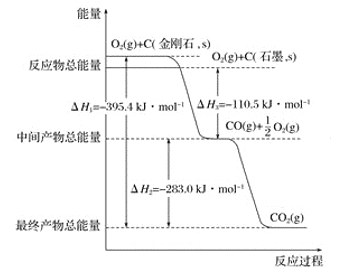
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨完全燃烧的热化学方程式:_______________________________________
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式: _______________________________________________________________。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为________。
【答案】金刚石 C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 石墨 C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ·mol-1 252.0 kJ
【解析】
根据热化学反应方程式的书写规则分析解答;根据盖斯定律分析解答。
由图示书写热化学方程式通常用三步法:第一步正确书写出化学反应方程式,第二步补加状态,第三步计算,由图计算对应的ΔH。
(1)含有1 mol C原子的金刚石和石墨完全燃烧生成二氧化碳,前者放出热量395.4 kJ,后者放出热量为110.5 kJ+283.0 kJ=393.5 kJ,可见金刚石放出能量多。石墨完全燃烧的反应方程式为C+O2===CO2;补加状态C(石墨,s)+O2(g)===CO2(g) ΔH=-QkJ·mol-1;图示为生成1 mol CO2对应热量,因此热化学方程式为C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
(2)图示中金刚石能量高于石墨,能量越低越稳定,所以石墨稳定。含有1 mol C原子的石墨的总能量比等质量的金刚石的总能量低(393.5-395.4) kJ =1.9 kJ,据此可写出反应的热化学方程式:C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ·mol-1。
(3)石墨质量是12 g,生成气体质量36 g,根据C、O元素守恒可求出CO、CO2的物质的量均为0.5 mol。则反应放出的热量为0.5 mol×110.5 kJ·mol-1+0.5 mol×393.5 kJ·mol-1=252.0 kJ。

 名校课堂系列答案
名校课堂系列答案【题目】某校化学实验小组在“探究碘水与FeCl2溶液能否反应”的系列实验中发现:在足量的稀KI溶液中,加入1~2滴FeCl3溶液,振荡后溶液呈黄色。
(查阅资料)
碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,碘水中含有碘单质;含Fe3+的溶液也呈黄色。
(提出问题)
Fe3+、I2的氧化性强弱情况。
(提出猜想)
(1)甲同学认为氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含______;乙同学认为氧化性Fe3+>I2,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含_______。
(设计实验并验证)
(2)为验证乙同学的观点正确,丙同学选用下面所提供的试剂设计出以下两种方案进行实验,请完成下列表格。供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
试剂 | 实验现象 | |
方案1 | ____________ | ______ |
方案2 | ______ | _________ |
(实验结论)
氧化性:Fe3+>I2。
(拓展应用)
(3)①根据上述实验推测,若在FeI2溶液中通入氯气,首先被氧化的离子是________。
②在100mL FeI2溶液中通入2.24LCl2(标准状况下),溶液中若有![]() 的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
的Fe2+ 被氧化,用离子方程式表示该反应过程:___。


