题目内容
【题目】某温度下,浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,该溶液呈中性的依据是( )
A.a=b
B.HA与BOH的电离常数相等
C.混合溶液中,c(H+)= ![]() mol/L
mol/L
D.混合溶液中,c(H+)+c(B+)═c(OH﹣)+c(A﹣)
【答案】C
【解析】解:A.浓度为a mol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,若a=b,则恰好反应生成盐,但是盐溶液不一定显中性,故A错误;
B.HA与BOH的电离常数相等,则二者等物质的量恰好反应时溶液显中性,但是,ab的关系不知道,无法确是否显中性,故B错误;
C.Kw=c(H+)×c(OH﹣),当c(H+)= ![]() mol/L,则c(H+)=c(OH﹣),即溶液显中性,故C正确;
mol/L,则c(H+)=c(OH﹣),即溶液显中性,故C正确;
D.混合溶液中,c(H+)+c(B+)═c(OH﹣)+c(A﹣),即电荷守恒,在酸性、碱性、中性溶液中均存在电荷守恒,故D错误.
故选C.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
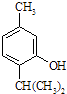
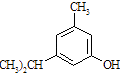
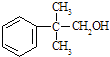
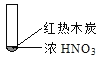
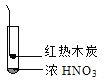
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应