题目内容
【题目】由Zn、Cu、Al、Fe四种金属中的两种组成的混合物41.5g,与足量的盐酸反应产生的氢气在标况下为22.4升,则混合物中一定含有的金属是 ( )
A.ZnB.FeC.AlD.Cu
【答案】C
【解析】
把两种金属看成一种金属,且反应后显+2价,令金属为R,与盐酸反应:R+2HCl=RCl2+H2↑,根据量,求出R的摩尔质量,然后进行分析;
把两种金属看成一种金属,令该金属为R,反应后金属显+2价,令R的摩尔质量为ag·mol-1,R与盐酸反应: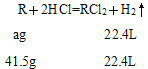 ,解得a=41.5。所以两种金属混合,要求金属折算成+2价后,一种金属的摩尔质量大于41.5g/mol,另一种小于41.5 g/mol,Zn的摩尔质量为65g·mol-1,Fe的摩尔质量为56g·mol-1,Al与盐酸反应后生成AlCl3,Al显+3价,转化成+2价,Al的摩尔质量为18g·mol-1,Cu的摩尔质量为64g·mol-1,因此混合物中一定含有的金属为Al,故选项C正确;
,解得a=41.5。所以两种金属混合,要求金属折算成+2价后,一种金属的摩尔质量大于41.5g/mol,另一种小于41.5 g/mol,Zn的摩尔质量为65g·mol-1,Fe的摩尔质量为56g·mol-1,Al与盐酸反应后生成AlCl3,Al显+3价,转化成+2价,Al的摩尔质量为18g·mol-1,Cu的摩尔质量为64g·mol-1,因此混合物中一定含有的金属为Al,故选项C正确;
答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

