题目内容
【题目】某兴趣小组欲制备漂白剂亚氯酸钠(NaClO2)。甲同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
实验I 乙同学利用下图所示装置制取NaClO2晶体
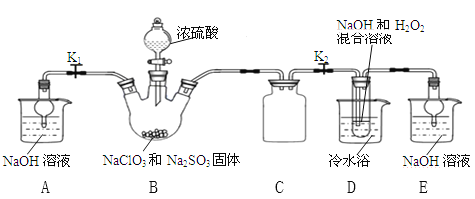
(l)装置B中使浓硫酸顺利滴下的操作是______,该装置中生成了ClO2,反应的化学方程式为_____________。
(2)装置A和E的作用是__________。
(3)装置D中发生反应的化学方程式为____________。
(4)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后进行的操作是_______,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。
实验Ⅱ 丙同学设计实验测定制得NaClO2样品的纯度
其实验步骤如下:
① 称取所得亚氯酸钠样品ag于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,配成100mL混合液。
② 取25.00 mL待测液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,消耗标准液体积的平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(5)步骤① 反应的离子方程式为______________。
(6)步骤② 滴定中使用的指示剂是_________。
(7)样品中NaClO2的质最分数为_______(用含a、b、V的代数式表示)。
【答案】 将分液漏斗活塞凹槽与漏斗上口部小孔对准,再开启分液漏斗旋塞 2NaClO3 + Na2SO3+ H2SO4 =2ClO2↑+2Na2SO4 + H2O 吸收ClO2,防止污染空气 2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑ 趁热过滤 ClO2-+4I-+4H+=2H2O+2I2+Cl- 淀粉溶液 ![]()
【解析】(l)为使装置B中分液漏斗中浓硫酸顺利滴下应进行的操作是将分液漏斗活塞凹槽与漏斗上口部小孔对准,再开启分液漏斗旋塞,氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为:2NaClO3+Na2SO3+H2SO4(浓)═2ClO2↑+2Na2SO4+H2O;
(2)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置A和装置E就是用NaOH溶液吸收反应产生的ClO2等尾气防止污染环境;
(3)装置D中是2ClO2在碱性条件下氧化H2O2生成氧气,本身还原为NaClO2,发生反应的化学方程式为2NaOH +2ClO2+ H2O2=2NaClO2+2H2O+O2↑;
(4)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,为防止析出晶体NaClO23H2O,应趁热过滤;
(5)步骤① 是溶液中ClO2-的氧化过量的I-生成I2,发生反应的离子方程式为ClO2-+4I-+4H+=2H2O+2I2+Cl-;
(6)碘遇淀粉变蓝色,反应结束时,碘反应完全变无色,则步骤② 滴定中使用的指示剂是淀粉;
(7)设样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g4mol
ag bmolL-1×V×10-3L×![]()
解得:a=![]() 。
。