题目内容
(12分)硫酸在国民经济中占有极其重要的地位,下图是工业接触法制硫酸的简单流程图,试回答下列有关问题.
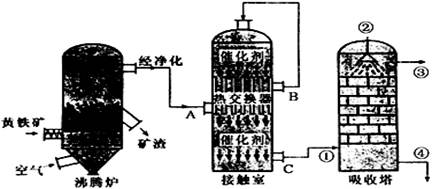
(1)在实际生产过程中,进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。按此密闭体系中气体的流向,则在B处流出的气体(除N2外)为 ;
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
①已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
②在400-500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(4)选择适应的催化剂,是否可以提高SO2的转化率? ;是否可以增大该反应所放出的热量? (填“是” 或“否”);
(5)若用浓硫酸吸收SO3可以得到H2SO4·SO3。用1000g 98 % 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是 。

(1)在实际生产过程中,进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。按此密闭体系中气体的流向,则在B处流出的气体(除N2外)为 ;
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
;
②在400-500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(4)选择适应的催化剂,是否可以提高SO2的转化率? ;是否可以增大该反应所放出的热量? (填“是” 或“否”);
(5)若用浓硫酸吸收SO3可以得到H2SO4·SO3。用1000g 98 % 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是 。
(12分)
(1)提高SO2的转化率
(2)SO2,O2
(3)①压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;
②增大压强对提高SO2转化率无显著影响,反而会增加成本;
(4)否 否 (5) 2.22kg
(1)提高SO2的转化率
(2)SO2,O2
(3)①压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;
②增大压强对提高SO2转化率无显著影响,反而会增加成本;
(4)否 否 (5) 2.22kg
略

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
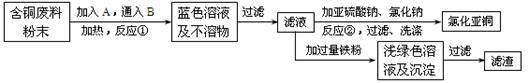
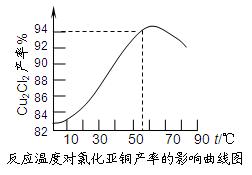

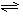 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
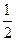 H2(g)+
H2(g)+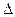 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 A + B + C
A + B + C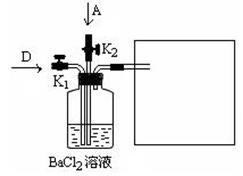
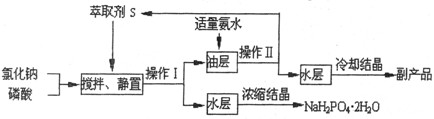
 NaH2PO4+HCl
NaH2PO4+HCl 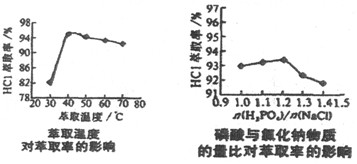
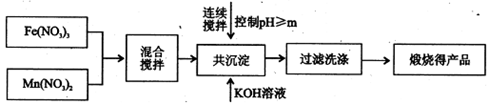
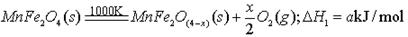
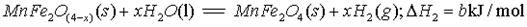
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用