题目内容
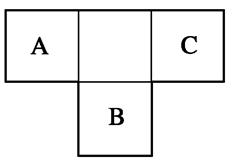
已知A、B、C、D分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请回答下列
问题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:_____________________________________________________。
(2)若B、D属于同主族元素形成的单质分子,写出C的化学式:________。
(3)若A、B均是含有2个原子核的微粒,且B中含有10个电子,D中含有18个电子,则A、B之间发生反应的离子方程式为_____________________。
(4)若D是一种含有22电子的分子,则符合如图所示转化关系的A为__________(写出物质的化学式,如果是有机物则写出相应的结构简式)。
(1)2F2+2H2O===4HF+O2 (2)H2O (3)HS-+OH-===S2-+H2O (4)CH3CH3(或CH3OH)
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
| A.升高温度 |
| B.加入高效催化剂 |
| C.将XQ3及时分离出去 |
| D.增大反应体系压强 |
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq)
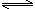 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/molCH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
 ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。