题目内容
如图为某原电池的结构示意图,下列说法正确的是
| A.原电池工作时,电子从铜极流向锌极 |
| B.原电池工作时,铜电极上发生氧化反应 |
| C.正极反应为Zn—2eˉ=Zn2+ |
| D.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应 |
D
解析试题分析:A、失去电子能力:Zn>Cu,则Zn、Cu分别是负极、正极,电子从负极流向正极,错误;B、负极上发生氧化反应,正极上发生还原反应,错误;C、负极反应式为Zn—2eˉ=Zn2+,正极反应式为Cu2++2eˉ=Cu,错误;D、电池反应式为Zn+Cu2+=Zn2++Cu,符合强制弱原理或能量判据,属于放热反应,正确。
考点:考查铜锌原电池的工作原理等相关知识。

练习册系列答案
相关题目
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下: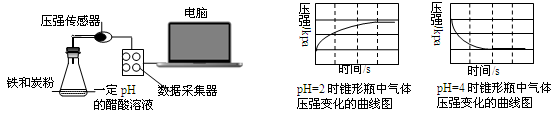
分析图像,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 | B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 | D.两溶液中负极反应均为:Fe – 2e→Fe2+ |
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示。下列说法正确的是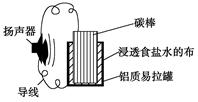
| A.碳棒上发生的主要反应为:2H++2e-=H2↑ |
| B.铝质易拉罐将逐渐得到保护 |
| C.电池总反应为:4Al+3O2+6H2O==4Al(OH)3 |
| D.电子方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |
某同学设计的铜锌原电池如右图所示,则下列说法正确的是
| A.因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作 |
| B.电池反应为:Zn2++Cu=Zn +Cu2+ |
| C.盐桥中的Cl-移向ZnSO4溶液 |
| D.在外电路中,电流从负极流向正极 |
下列金属防腐的措施中,使用外加电流阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.汽车底盘喷涂高分子膜 |
| C.金属护栏表面涂漆 |
| D.地下钢管连接锌块 |
用石墨电极电解CuCl2溶液(见图)。下列分析正确的是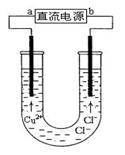
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2+ + 2e- = Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
惰性电极电解下列溶液,电解一段时间,阴极质量增加,电解液的pH下降的是
| A.CuSO4 | B.NaCl | C.NaOH | D.H2SO4 |
有关阳离子交换膜电解饱和食盐水的(装置如图)说法错误的是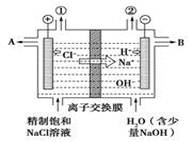
| A.转移电子0.8 mol时产生氢气8.96 L(标准状况) |
| B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液 |
| C.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| D.装置中的阳离子交换膜只能让阳离子通过,不能让 |
下图的各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是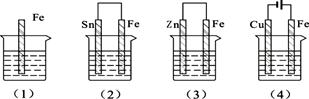
| A.⑷>⑵>⑴>⑶ | B.⑵>⑴>⑶>⑷ |
| C.⑷>⑵>⑶>⑴ | D.⑶>⑵>⑷>⑴ |