题目内容
已知下列两个热化学方程式:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH 1=-2 983.2 kJ/mol
②P(红磷,s)+O2(g)=P4O10(s) ΔH 2=-738.5 kJ/mol
(1)试写出白磷转化为红磷的热化学方程式: 。
(2)相同的状况下,白磷与红磷能量较低的是: ;白磷的稳定性比红磷: (填“高”或“低”)。
(3)已知键能数据,P-P:a kJ/mol;O=O:b kJ/mol;
P-O:c kJ/mol;P=O:d kJ/mol,破坏化学键要吸收能量,形成化学键要放出能量。参考如图物质结构,写出 a、b、c、d满足的关系式: 。

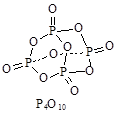
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH 1=-2 983.2 kJ/mol
②P(红磷,s)+O2(g)=P4O10(s) ΔH 2=-738.5 kJ/mol
(1)试写出白磷转化为红磷的热化学方程式: 。
(2)相同的状况下,白磷与红磷能量较低的是: ;白磷的稳定性比红磷: (填“高”或“低”)。
(3)已知键能数据,P-P:a kJ/mol;O=O:b kJ/mol;
P-O:c kJ/mol;P=O:d kJ/mol,破坏化学键要吸收能量,形成化学键要放出能量。参考如图物质结构,写出 a、b、c、d满足的关系式: 。

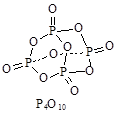
(1)P4(白磷,s)=4P(红磷,s) ΔH=-29.2 kJ·mol-1
(2)红磷 低
(3)12c+4d-6a-5b=2 983.2 (或6a+5b-12c-4d=-2 983.2 )
(2)红磷 低
(3)12c+4d-6a-5b=2 983.2 (或6a+5b-12c-4d=-2 983.2 )
试题分析:(1)根据盖斯定律可知,①-②即得到P4(白磷,s)=4P(红磷,s) ΔH=-29.2 kJ·mol-1。
(2)白磷转化为红磷的反应是放热反应,所以白磷的能量高于红磷的,因此红磷比白磷稳定。
(3)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据物质的结构可知6a+5b-12c-4d=-2 983.2,解得12c+4d-6a-5b=2 983.2。
点评:在进行反应热的有关计算时,应该根据能量守恒定律利用盖斯定律进行列式计算。

练习册系列答案
相关题目
 CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。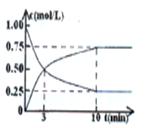
 CH3CH2OH(l) + CH3COOH(l) ;△H
CH3CH2OH(l) + CH3COOH(l) ;△H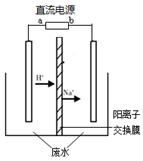
 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2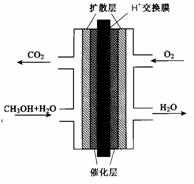
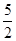 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1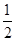 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1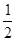 O2(g)====H2O(g) ΔH1=-Q1 kJ·mol-1
O2(g)====H2O(g) ΔH1=-Q1 kJ·mol-1