题目内容
4.已知A、B两种元素,A能与氧形成A2O2化合物,其中A的质量分数为70.91%;B单质在常温下是一种易挥发的液体物质,B的氢化物水溶液是强酸,通过计算和推理回答A、B各是什么元素.分析 根据A2O2中A的质量分数为70.91%,计算A的相对原子质量,进而确定A为何种元素,B单质在常温下是一种易挥发的液体物质,B的氢化物水溶液是强酸,则B为Br元素.
解答 解:A2O2中A的质量分数为70.91%,则Mr(A):Mr(O)=Mr(A):16=70.91%:(1-70.91%),解得Mr(A)=39,故A为K元素;由于常温下液溴为易挥发的液体物质,HBr水溶液为强酸,则B为Br元素,
答:A为K元素、B为Br元素.
点评 本题考查元素推断,注意利用化学式计算A的相对原子质量确定A元素,注意对基础知识的理解掌握.

练习册系列答案
相关题目
14.下列做法不利于环境保护的是( )
| A. | 使用可降解塑料制品 | |
| B. | 工业废气排入大气 | |
| C. | 对化石燃料进行综合利用 | |
| D. | 尽量采取步行、骑自行车或乘坐公共交通工具等方式出行 |
12.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 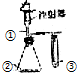 |
| A | 稀盐酸 | Na2SO4 | 溴水 | SO2具有漂白性 | |
| B | 浓氨水 | CaO | AlCl3溶液 | 白色沉淀生成后又溶解 | |
| C | 双氧水 | MnO2 | KI溶液 | 氧化性:O2>I2 | |
| D | 稀醋酸 | Na2CO3 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
16.设NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| C. | 60g冰醋酸中,所含阴、阳离子总数为2NA | |
| D. | 标准状况下,3.36L乙烷中含有的非极性键数为1.05NA |
13.下列物质不能与Cl2反应的是( )
| A. | H2O | B. | NaOH溶液 | C. | Fe | D. | 浓H2SO4 |
 .
.
 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.