题目内容
【题目】I、Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂。已知K2FeO4在Fe3+和Fe(OH)3催化下会分解,在酸性或弱碱性能与水反应生成Fe(OH)3和O2。生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O
(1)该反应中氧化剂是______________(写电子式)
(2)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_____________________(回答一条即可)。
(3)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是__________________________________________。
②原样品中高铁酸钾的质量分数为______________。
II、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/moL ①
C(s)+O2(g)=CO2(g) △H=–393.5kJ/moL ②
2C(s)+O2(g)=2CO(g) △H=–221.0kJ/moL ③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__。
,请写出此反应的热化学方程式:__。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是___________(填序号)
a.容器中的压强不变
b.2v正(CO)= v逆(N2)
c.气体的平均相对分子质量保持34.2不变
d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO3(g) ![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
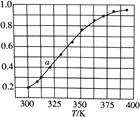
图中a点对应温度下,已知SO3的起始压强为P0kPa,该温度下反应的平衡常数KP=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中按![]() =1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
=1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
【答案】 ![]() K2FeO4在强碱性溶液中比较稳定(或减少K2FeO4在Fe3+作用下分解) 滴入最后一滴Na2S2O3标准液,溶液由蓝色变无色,且半分钟内不变色 39.6% 2NO(g)+2CO(g)
K2FeO4在强碱性溶液中比较稳定(或减少K2FeO4在Fe3+作用下分解) 滴入最后一滴Na2S2O3标准液,溶液由蓝色变无色,且半分钟内不变色 39.6% 2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=–746.5kJ/mol acd 4P0/45 向逆反应方向移动
N2(g)+2CO2(g) △H=–746.5kJ/mol acd 4P0/45 向逆反应方向移动
【解析】(1)根据反应可知KClO中+1价的氯变为氯化钾中-1价的氯,发生了还原反应,KClO是氧化剂,它为离子化合物,电子式为:![]() ;正确答案:
;正确答案:![]() 。
。
(2)铁离子水解显酸性,K2FeO4水解显碱性,酸性和碱性溶液混合,会相互促进水解,得到的K2FeO4的量会减少,因此制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,让Fe(NO3)3溶液尽可能反应彻底;正确答案:K2FeO4在强碱性溶液中比较稳定(或减少K2FeO4在Fe3+作用下分解)。
(3)①淀粉遇到碘水会变蓝色,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,溶液由蓝色变无色,且半分钟内不变色,达到滴定终点;正确答案:滴入最后一滴Na2S2O3标准液,溶液由蓝色变无色,且半分钟内不变色。
②根据反应2Na2S2O3+I2=Na2S4O6+2NaI可知:2Na2S2O3----I2,消耗碘的量为n(I2)= (1.0×18.00×10-3)/2=9×10-3 mol;再根据电子守恒规律可知:高铁酸钾中铁元素得电子总数等于碘单质失电子总数:设有K2FeO4为xmol,则x×(6-3)=9×10-3×2(0-(-1)),解之得:x=6×10-3mol;原样品中高铁酸钾的质量分数为(6×10-3×198)/3×100%=39.6%;正确答案:39.6%。
(4)平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值,根据![]() ,可知此反应的热化学方程式为2NO(g)+2CO(g)
,可知此反应的热化学方程式为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),然后再根据盖斯定律:反应③-②×2-①,可得△H=–746.5kJ/mol;所以该反应的热化学方程式为2NO(g)+2CO(g)
N2(g)+2CO2(g),然后再根据盖斯定律:反应③-②×2-①,可得△H=–746.5kJ/mol;所以该反应的热化学方程式为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=–746.5kJ/mol;正确答案:2NO(g)+2CO(g)
N2(g)+2CO2(g) △H=–746.5kJ/mol;正确答案:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=–746.5kJ/mol。
N2(g)+2CO2(g) △H=–746.5kJ/mol。
(5)该反应为反应前后气体的物质的量有变化的反应,当容器中的压强不变,反应达到化学平衡状态,a正确;速率和系数成正比,应为v正(CO)= 2v逆(N2),b错误;反应前后气体的总质量不变,气体的总量在发生变化,当气体的总量不再发生变化,气体的平均相对分子质量为定值,反应到化学平衡状态,c正确;该反应为放热反应,当温度不再发生改变,平衡常数保持不变,达到平衡状态,d正确; NO和CO两种反应是按照1:1投料、1:1反应,任何时候剩余的量都是1:1,无法判定反应是否达到化学平衡状态,e错误;正确选项acd。
(6)设起始SO3 为amol,根据题给信息有
2SO3(g) ![]() 2SO2(g)+O2(g),
2SO2(g)+O2(g),
起始量 a 0 0
变化量 0.4a 0.4a 0.2 a
平衡量 0.6a 0.4 a 0.2 a
反应达到平衡后,气体的压强为a/(0.6a+0.4 a+ 0.2 a)= P0/p(平衡),p(平衡)=1.2 P0;SO3物质的量分数:0.6a/(0.6a+0.4 a+ 0.2 a)=1/2;;SO2物质的量分数:0.4 a /(0.6a+0.4 a+ 0.2 a)=1/3; O2物质的量分数: 0.2 a/(0.6a+0.4 a+ 0.2 a)=1/6;该温度下反应的平衡常数KP=(1/6×p(平衡))×(1/3×p(平衡))2/(1/2×p(平衡))2= 4P0/45;设容器的体积为1L,设起始SO3 为1mol,反应达平衡时平衡常数为0.2×0.42/0.62=0.8/9=0.09;假设再向容器中按![]() =1加入SO2和SO3,分别为1mol,这时,n(SO3)=1.6 mol, n(SO2)=1.4 mol, n(O2)=0.2 mol, 反应的浓度商为Qc==0.2×1.42/1.62=0.15>0.09;平衡向左移;正确答案:4P0/45;向逆反应方向移动。
=1加入SO2和SO3,分别为1mol,这时,n(SO3)=1.6 mol, n(SO2)=1.4 mol, n(O2)=0.2 mol, 反应的浓度商为Qc==0.2×1.42/1.62=0.15>0.09;平衡向左移;正确答案:4P0/45;向逆反应方向移动。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②