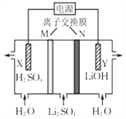
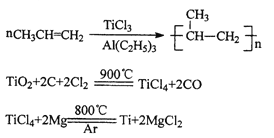
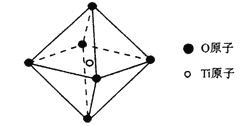
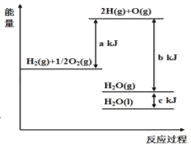
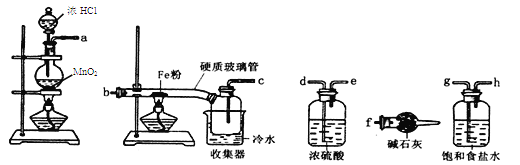
题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1 mol/L K2SO4溶液中含有K+数目为 0.2NA
B. 将1 mL 5 mol/L的FeCl3溶液滴入100 mL沸水并继续煮沸至液体呈红褐色,所得分散系含胶粒数为0.005NA
C. 常温常压下,1.56 g Na2O2含有阴离子个数为0.02NA
D. 28 g铁粉与高温水蒸气反应,生成H2数目为0.5NA
【答案】C
【解析】
A. 0.1 mol/L K2SO4溶液的体积未知,则不能计算溶液中含有K+数目,A错误;
B. 将1 mL 5 mol/L的FeCl3溶液滴入100 mL沸水并继续煮沸至液体呈红褐色即得到氢氧化铁胶体,由于胶体是大分子的集合体,则所得分散系含胶粒数小于0.005NA,B错误;
C. 常温常压下,1.56 g Na2O2的物质的量是1.56g÷78g/mol=0.02mol,由于过氧化钠是由钠离子和过氧根离子组成的氧化物,则其中含有的阴离子个数为0.02NA,C正确;
D. 28 g铁粉的物质的量是28g÷56g/mol=0.5mol,与高温水蒸气反应3Fe+4H2O(g)![]() Fe3O4+4H2,所以生成H2数目为
Fe3O4+4H2,所以生成H2数目为![]() ,D错误。
,D错误。
答案选C。

练习册系列答案
相关题目