题目内容
【题目】(1)0.5molCH4的质量是_______________g,在标准状况下的体积为_______________L;含有约______________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____
【答案】8 11.2 1.204×1024 5 mol·L-1
【解析】
(1)依据n=m/M、n=V/22.4及CH4的组成解答;
(2)依据c=n/v计算。
(1)0.5molCH4的质量为:m(CH4)=0.5mol![]() 16g/mol=8g, 在标准状况下的体积为:V=0.5mol
16g/mol=8g, 在标准状况下的体积为:V=0.5mol![]() 22.4L/mol=11.2L,所含的氢原子个数约为:0.5
22.4L/mol=11.2L,所含的氢原子个数约为:0.5![]() 4
4![]() =1.204×1024个;
=1.204×1024个;
本题答案为:8 , 11.2 ,1.204×1024。
(2)标准状况下22.4 L的HCl的物质的量为:n(HCl)=22.4L/22.4L/mol=1mol,将HCl溶于水,配成200 mL的溶液,所得溶液的物质的量浓度为:c(HCl)=1mol/0.2L=5mol/L;
本题答案为:5mol/L。

【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】从元素化合价和物质类别两个角度研究物质的性质,是一种行之有效的方法。以下是铁元素组成物质的二维图的部分信息。
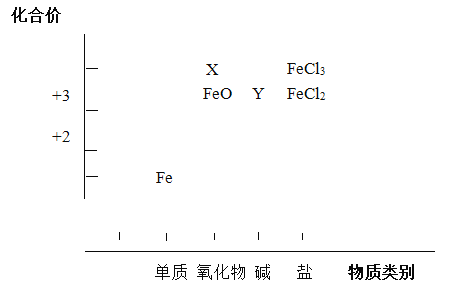
(1)分别写出X、Y的化学式______、______。
(2)写出FeO与稀硫酸反应的化学方程式____________。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的反应的离子方程式。
| 离子方程式 |
氧化性 | ____________________ (一个即可) |
还原性 | ____________________ (一个即可) |
(4)某同学预测Fe3+可以与S2-发生反应,为验证预测,他结合资料信息,选择了两种试剂进行实验,确认了反应的发生。
资料:部分硫化物的溶解性表(室温)
阴离子 阳离子 | S2- |
Na+ | 溶 |
Fe3+ | 不 |
Fe2+ | 不 |
选取的试剂是______和______;可能发生的两种不同原理的反应的离子方程式是:_________、__________。