题目内容
短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
A.XY2一定是分子晶体
B.XY2的电子式可能是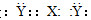
C.XY2水溶液不可能呈碱性
D.X可能是ⅣA、ⅤA或ⅥA族元素。
A
解析

练习册系列答案
相关题目
下列有关元素及其化合物性质的比较正确的是
| A.原子半径:F<O<Al | B.稳定性:H2O<PH3<NH3 |
| C.酸性:H2CO3<H2SO4<H3PO4 | D.碱性:LiOH<NaOH<Al(OH)3 |
核电荷数为1~18的元素中,下列说法正确的是( )
| A.最外层只有1个电子的元素一定是金属元素 |
| B.最外层有2个电子的元素一定是金属元素 |
| C.原子核外各层电子数相等的元素一定是金属元素 |
| D.最外层电子数为7的原子,最高正价为+7 |
2011年3月11日,日本福岛核电站因为9.0级大地震引发的海啸受损,产生严重的核泄漏。核泄漏物中含放射性元素碘-131,则有关碘-131(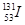 )和碘-127(
)和碘-127( )说法正确的是( )
)说法正确的是( )
A.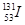 和 和 的中子数相同,是同一种核素 的中子数相同,是同一种核素 |
B.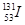 和 和 的质子数相同,互为同位素 的质子数相同,互为同位素 |
C.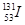 和 和 的核外电子排布方式不同 的核外电子排布方式不同 |
D.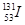 有放射性而 有放射性而 无放射性,说明两者化学性质不同 无放射性,说明两者化学性质不同 |
下列各组粒子:①H3O+,NH4+,Na+;②OH-,NH2-,F-;③O2-,Na+,Mg2+;④CH4,NH3,H2O。具有相同质子数和电子数的正确组合是( )
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
下列说法正确的是( )
| A.F、Cl、Br的最外层电子数都是7,次外层电子数都是8 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律 |
| C.卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加电子层数增大起主要作用 |
| D.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,砹易溶于水,难溶于CCl4 |
下列叙述中正确的是( )
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.除短周期外,其他周期均有18种元素 |
| C.副族元素中没有非金属元素 |
| D.碱金属元素是指IA族的所有元素 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙=丁+己,甲+丙=戊+己; 0.1 mol·L-1丁溶液的pH为13(25 ℃)。下列说法正确的是( )
| A.原子半径:W>Z>Y>X |
| B.Y元素在周期表中的位置为第3周期第ⅣA族 |
| C.1 mol甲与足量的乙完全反应共转移1 mol电子 |
| D.化合物甲中只有离子键 |