题目内容
用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
| A.FeO | B.Fe2O3 | C.CaO | D.Cu2O |
B
此题可用原子守恒法来解。CO被氧化为CO2,增加的氧原子全部来源于金属氧化物。
n(O)=n(CaCO3)=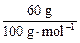 ="0.6" mol;金属氧化物中金属的质量为:32 g-0.6 mol×16 g·mol-1="22.4" g。则
="0.6" mol;金属氧化物中金属的质量为:32 g-0.6 mol×16 g·mol-1="22.4" g。则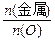 =
=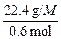 ,然后把各选项中的原子个数比代入求出M,只有M="56" g·mol-1时合理。
,然后把各选项中的原子个数比代入求出M,只有M="56" g·mol-1时合理。
n(O)=n(CaCO3)=
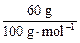 ="0.6" mol;金属氧化物中金属的质量为:32 g-0.6 mol×16 g·mol-1="22.4" g。则
="0.6" mol;金属氧化物中金属的质量为:32 g-0.6 mol×16 g·mol-1="22.4" g。则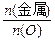 =
=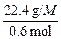 ,然后把各选项中的原子个数比代入求出M,只有M="56" g·mol-1时合理。
,然后把各选项中的原子个数比代入求出M,只有M="56" g·mol-1时合理。
练习册系列答案
相关题目
 现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则: 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经