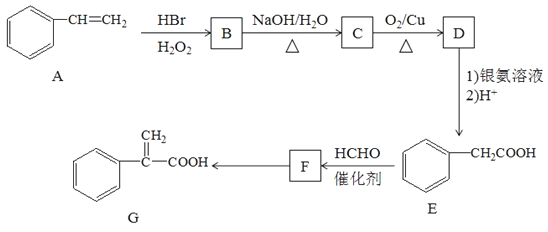
题目内容
【题目】在80℃时,将0.40 mol的四氧化二氮气体充入2 L的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.20 | a | 0.10 | c | d | e |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应的化学方程式为________________________。
(2)该反应在0~20 s内N2O4的平均反应速率为____________。
(3)在80℃时该反应的平衡常数K值为______________。
(4)在20s时,浓度熵Qc_________(填“>”、“<”或“=”)平衡常数K。
【答案】N2O4![]() 2NO2 0.003 mol·L-1·s-1 0.4<
2NO2 0.003 mol·L-1·s-1 0.4<
【解析】
(1)将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,反应的化学方程式为N2O4![]() 2NO2,故答案为:N2O4
2NO2,故答案为:N2O4![]() 2NO2;
2NO2;
(2)进行到20s,N2O4![]() 2NO2
2NO2
起始量(mol) 0.4 0
变化量(mol) 0.12 0.24
20s末(mol) 0.28 0.24
20s时,N2O4的浓度=![]() =0.14mol/L;0~20s内N2O4的平均反应速率=
=0.14mol/L;0~20s内N2O4的平均反应速率=![]() =0.003mol/(Ls),故答案为:0.003mol/(Ls);
=0.003mol/(Ls),故答案为:0.003mol/(Ls);
(3)N2O42NO2,平衡常数K=![]() ,80°C平衡状态和40s是相同平衡状态,平衡浓度c(NO2)=0.20mol/L,c(N2O4)=0.10mol/L;平衡常数K=
,80°C平衡状态和40s是相同平衡状态,平衡浓度c(NO2)=0.20mol/L,c(N2O4)=0.10mol/L;平衡常数K=![]() ═
═![]() =0.4mol/L,故答案为:0.4;
=0.4mol/L,故答案为:0.4;
(4)在20s时,未建立平衡,正反应速率大于逆反应速率,此时浓度熵Qc<平衡常数K,故答案为:<。

 阅读快车系列答案
阅读快车系列答案【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为()
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 硫酸钡 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 乙醇 |
D | 碘酒 | 食盐水 | 氯化铜 | 碳酸钙 |
A.AB.BC.CD.D