题目内容
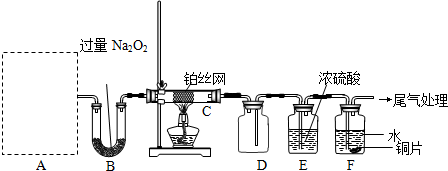
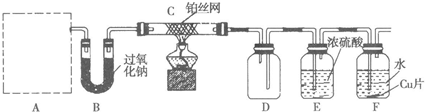
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
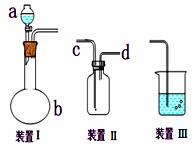
(1)甲认为装置Ⅰ可作为实验室快速制氧气的发生器,则装置Ⅰ的b仪器中可加入
____,装置Ⅱ从_____管口进气可作为![]() 的收集装置。
的收集装置。
(2)乙认为利用装置Ⅰ可以制取乙炔,则装置Ⅰ的a仪器中可加入____ (写名称),写出实验室制取乙炔的化学方程式: __________________________________
(3)丙认为利用装置Ⅱ,可收集NO,试简述操作方法:_________________。
(4)丁认为利用装置Ⅰ和装置Ⅲ,可验证![]() 的氧化性比Br2强,进行此项实验时在装置Ⅰ中的a仪器中加入_____(写名称),装置Ⅲ中应加入适量的_____(写化学式),根据装置Ⅲ中观察到_ 的实验现象即可得出C12的氧化性比
的氧化性比Br2强,进行此项实验时在装置Ⅰ中的a仪器中加入_____(写名称),装置Ⅲ中应加入适量的_____(写化学式),根据装置Ⅲ中观察到_ 的实验现象即可得出C12的氧化性比![]() 强的结论。
强的结论。
(16分)(1)H2O2溶液或H2O c (每空2分)
(2)饱和食盐水(2分) CaC2 + 2H2O ===Ca(OH)2 + C2H2↑(2分)
(3)将广口瓶中盛满水,NO从d管口通入,当瓶中的水全部排净后,NO就收集满了(2分)
(4)浓盐酸(2分) NaBr(或KBr)溶液(合理即可得分)(2分) 溶液由无色变橙色(或黄色或橙黄色)(2分)

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目