题目内容
【题目】近年来,蜂胶已成为保健品的宠儿,其主要成分CAPE(咖啡酸苯乙酯)因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领域广泛应用。通过下列途径可合成咖啡酸苯乙酯。

已知:A的核磁共振氢谱(1HNMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显色反应。
(1)丙二酸的结构简式为________________。
(2)咖啡酸苯乙酯含有的含氧官能团名称为_________________________。
(3)咖啡酸苯乙酯的分子式为________________,D的结构简式为____________________。
(4)反应类型:B―→C______________。
(5)A―→B的化学方程式为_______________________________________________________。
(6)写出同时满足下列条件的C的所有同分异构体的结构简式(不考虑立体异构):________________。
a.属于酯类
b.能发生银镜反应
c.与FeCl3溶液发生显色反应
【答案】 HOOCCH2COOH 酯基 (酚)羟基 C17H16O4  取代反应
取代反应 

【解析】A的核磁共振氢谱(1HNMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显示反应,说明A中含有酚羟基,根据A的分子式可以知道,A为![]() ,根据B的分子式可以知道,A发生取代反应生成B为
,根据B的分子式可以知道,A发生取代反应生成B为 ,B在碱性条件下水解再酸化得C为
,B在碱性条件下水解再酸化得C为 ,根据D的分子式可以知道,C与丙二酸反应生成D为
,根据D的分子式可以知道,C与丙二酸反应生成D为 ,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为
,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为 ,据此答题。
,据此答题。
(1)丙二酸的结构简式为HOOCCH2COOH,
因此,本题正确答案是:HOOCCH2COOH;
(2)咖啡酸苯乙酯为 ,咖啡酸苯乙酯含有的含氧官能团名称为 酯基、(酚)羟基,
,咖啡酸苯乙酯含有的含氧官能团名称为 酯基、(酚)羟基,
因此,本题正确答案是:酯基、(酚)羟基;
(3)根据咖啡酸苯乙酯的结构简式可以知道,其分子式为C17H16O4,D的结构简式为 ,
,
因此,本题正确答案是:C17H16O4; ;
;
(4)根据上面的分析可以知道,B→C反应类型为取代反应,
因此,本题正确答案是:取代反应;
(5)A→B的化学方程式为 ,
,
因此,本题正确答案是: ;
;
(6)C为 ,根据条件a.属于酯类,说明有酯基,b.能发生银镜反应,说明有醛基,c.与FeCl3溶液发生显色反应,说明有酚羟基,则符合条件的同分异构体的结构简式为:
,根据条件a.属于酯类,说明有酯基,b.能发生银镜反应,说明有醛基,c.与FeCl3溶液发生显色反应,说明有酚羟基,则符合条件的同分异构体的结构简式为: ,
,
因此,本题正确答案是: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
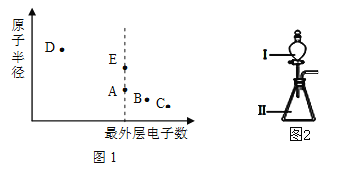
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_______(用离子符号表达)。
(2)W的最简单氢化物的电子式为______。
(3)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为:________。Y的最高价氧化物与Z的气态氢化物的水溶液反应的离子方程式:__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
【题目】键能的大小可用于计算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g)= 2HCl(g)过程中,当生成1molHCl气体时需要___(填“吸收”或“放出” )____kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___kJ·mol-1。
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______(用含ΔH1、ΔH2、ΔH3的式子表示)。
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
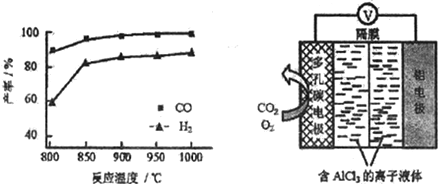
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。