��Ŀ����
����Ŀ����NAΪ�����ӵ�����������������ȷ���ǣ����ԭ������O��16 Na��23���� ��
A.25��ʱ��pH=13��1.0 L Ba��OH��2��Һ�к��е�OH����ĿΪ0.2NA
B.100 mL 1 molL��1��H2SO4��Һ�к���0.1NA��H+
C.��4 g NaOH����100 g����ˮ�У�������Һ���ʵ���Ũ����0.1 molL��1
D.20g��ˮ��D2O�������ĵ�����Ϊ10NA
���𰸡�D
���������⣺A��pH=13��1.0LBa��OH��2��Һ�У�ˮҲ�ܵ�������������ӣ����Ժ��е�OH����Ŀ����0.2NA �� ��A����B��H2SO4��2H+ �� 100 mL 1 molL��1��H2SO4��Һ�к���0.2NA��H+ �� ��B����
C����4g NaOH����100 g����ˮ�У���ʱ��Һ���������0.1L����C����
D��20g��ˮ��D2O�������ĵ��ӵ����ʵ����� ![]() x10=10mol��������Ϊ10NA �� ��D��ȷ��
x10=10mol��������Ϊ10NA �� ��D��ȷ��
��ѡD��

��ϰ��ϵ�д�
 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
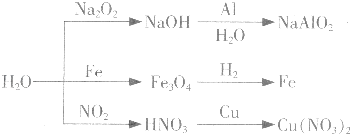
�����Ŀ