题目内容
某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验).
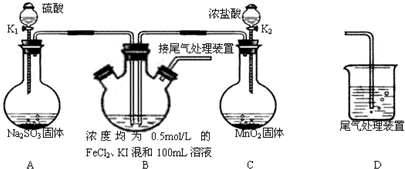
(1)上述实验需要加热的装置是______
(2)D中,烧杯盛放的是______
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式______
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入______溶液,现象是______
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是______
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为______.

(1)上述实验需要加热的装置是______
(2)D中,烧杯盛放的是______
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式______
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入______溶液,现象是______
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是______
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为______.
(1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气,所以加热的仪器是C,故答案为:C;
(2)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液,故答案为:氢氧化钠溶液(NaOH溶液);
(3)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,但是不能将亚铁离子氧化,
故答案为:2I-+Cl2═I2+2Cl-;
①碘离子可以被氧化为单质碘,碘单质遇到淀粉变为蓝色,据此可以用淀粉检验碘单质的产生,故答案为:淀粉溶液;溶液呈蓝色;
②比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2开K1,故答案为:A;
(4)铁离子和二氧化硫之间的反应实质是:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025mol,体积是:0.025mol×22.4L/mol=0.56L,故答案为:0.56L.
(2)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液,故答案为:氢氧化钠溶液(NaOH溶液);
(3)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,但是不能将亚铁离子氧化,
故答案为:2I-+Cl2═I2+2Cl-;
①碘离子可以被氧化为单质碘,碘单质遇到淀粉变为蓝色,据此可以用淀粉检验碘单质的产生,故答案为:淀粉溶液;溶液呈蓝色;
②比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2开K1,故答案为:A;
(4)铁离子和二氧化硫之间的反应实质是:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025mol,体积是:0.025mol×22.4L/mol=0.56L,故答案为:0.56L.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 2NH3是放热反应
2NH3是放热反应