��Ŀ����
����Ŀ��I��д�����л���������ƻ�ṹ��ʽ��
�� ������Ϊ________________________.
������Ϊ________________________.
�� ������Ϊ______________________________.
������Ϊ______________________________.
II����֪�л�������X�и�Ԫ�ص����������ֱ�ΪC---60%��H---13.3%��O---26.7%��
����գ�
��1���л���X��ʵ��ʽΪ____________����0.1molX�����������г��ȼ������������10.08L����״��������X�ķ���ʽΪ________��
��2��ʵ�������X��������Ʒ�Ӧ����H2��X���ӵĺ˴Ź�����������4�����շ壬�����֮��Ϊ3:2:2:1����X�����к��еĹ����ŵ�����Ϊ_________��X�Ľṹ��ʽΪ_____________��
��3��X������ͬ���칹��Y��Z������Y��������Ʒ�Ӧ����H2����Z���ܡ���Y��Z�Ľṹ��ʽ�ֱ�Ϊ_______________��_______________
���𰸡� 2��2��6��������4-�һ����� 3������2���һ���1����ϩ C3H8O C3H8O �ǻ� ![]()

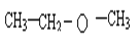
��������I���� ���̼������8��Cԭ�ӣ�����֧���Ͻ�����˿�ʼ��ţ�2��C����2������6��C��Ҳ��1������4��C����1���һ���������ϵͳ������������Ϊ2��2��6��������4-�һ����� .
���̼������8��Cԭ�ӣ�����֧���Ͻ�����˿�ʼ��ţ�2��C����2������6��C��Ҳ��1������4��C����1���һ���������ϵͳ������������Ϊ2��2��6��������4-�һ����� .
��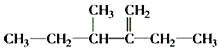 �İ���������̼̼˫�����ڵ��̼������5��Cԭ�ӣ���������ŽϽ���̼ԭ�ӿ�ʼ��ţ�2��Cԭ������1���һ���3��Cԭ������1����������������Ϊ3������2���һ���1����ϩ.
�İ���������̼̼˫�����ڵ��̼������5��Cԭ�ӣ���������ŽϽ���̼ԭ�ӿ�ʼ��ţ�2��Cԭ������1���һ���3��Cԭ������1����������������Ϊ3������2���һ���1����ϩ.
II����X�и�Ԫ�ص����������ֱ�ΪC---60%��H---13.3%��O---26.7%���������C��H��OԪ�ص�ԭ�Ӹ�����Ϊ![]() ��
�� ![]() ��
�� ![]() =3��8��1.
=3��8��1.
��1���л���X��ʵ��ʽΪC3H8O����0.1molX�����������г��ȼ�������ı�״������10.08L��0.45mol������1molX����������4.5mol����X�ķ���ʽΪC3H8O��������ʵ��ʽ��Hԭ�����Ѵﱥ��Ҳ��ȷ������ʽ�ˡ���
��2��X��������Ʒ�Ӧ����H2������Xһ���Ǵ���X���ӵĺ˴Ź�����������4�����շ壬�����֮��Ϊ3:2:2:1����Xһ�����Ҵ���������Ϊ�ǻ����ṹ��ʽΪ![]() ��
��
��3���Ҵ�������ͬ���칹��Y��Z������Y��������Ʒ�Ӧ����H2��Y��2-������Z������Z�Ǽ�������Y��Z�Ľṹ��ʽ�ֱ�Ϊ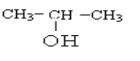 ��
��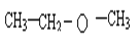 ��
��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ����ȩ������ͭ�������ڵ������£����Ա��������������ᡣ���ݴ�ԭ�����ʵ�飬�����Թ�C���ռ�������������Һ����ͼ��ʾ���Թ�A��װ��40������ȩˮ��Һ������ͭ��ĩ���Թ�C��װ����������ˮ���ձ�B��װ��ijҺ�壩����֪��60�桫80��ʱ��˫�����������������ɷ�����ȩ��������Ӧ����������ʮ���η�Ӧ������ȫ���й����ʵķе���±���
���� | ��ȩ | ���� | ���� | �Ҷ��� | ˮ |
�е� | 20.8�� | 117.9�� | 290�� | 197.2�� | 100�� |

��ش��������⣺
��1���Թ�A����60�桫80��ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��ע����Ӧ������____________________________________��
��2����ͼ��ʾ��ʵ��IJ�ͬ�Σ���Ҫ�����¶ȼ����Թ�A�е�λ�ã���ʵ�鿪ʼʱ��Ϊ���Ʋ�������Ӧ��Һ���¶ȣ��¶ȼ�ˮ�����λ��Ӧ��_____________�����Թ�A�е���Ҫ��Ӧ��ɺ�Ϊ��C���ռ����ᣬ�¶ȼ�ˮ�����λ��Ӧ��______________���ò�������Ϊ _____________���ձ�B��ʢװ��Һ�������____________��д��һ�ּ��ɣ�������������ң���
��3�������Ƿdz���Ҫ�Ĺ�ҵԭ�ϣ����ȴ������������ڹ�ҵ������ʳƷ�㾫�������� ����ʵ����ģ�ҵ�����������£�
����ʵ����ģ�ҵ�����������£�

��Ӧ��I�з�����Ӧ�ķ�Ӧ������___________��
������II�IJ���Ϊ������NaHCO3��Һϴ�Ӻ��Һ�����л�����ˮϴ�Ӻ��Һ��
ϴ��ʱ������NaOH��Һ����NaHCO3��Һ����ԭ����__________________________���û�ѧ����ʽ��ʾ����



