题目内容
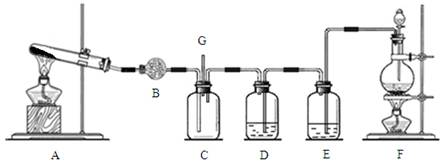
(12分)实验室用如图所示装置制取并收集NO,请回答下列问题:
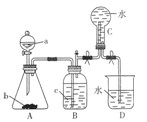
(1)仪器a的名称是 。
(2)写出A中反应的化学方程式 ,其中HNO3表现的性质是 ,当有4molHNO3被还原时该反应中转移电子总数为 。
(3)装置B的作用是
;
(4)A中产生的现象有 。

(1)仪器a的名称是 。
(2)写出A中反应的化学方程式 ,其中HNO3表现的性质是 ,当有4molHNO3被还原时该反应中转移电子总数为 。
(3)装置B的作用是

;
(4)A中产生的现象有 。
(1)分液漏斗
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 2NO+O2=2NO2,酸性、氧化性,12NA
(3)洗去NO2气体和挥发出来的HNO3
(4)铜屑溶解,溶液变蓝,产生无色气体,在锥形瓶上部变为红棕色
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 2NO+O2=2NO2,酸性、氧化性,12NA
(3)洗去NO2气体和挥发出来的HNO3
(4)铜屑溶解,溶液变蓝,产生无色气体,在锥形瓶上部变为红棕色
略

练习册系列答案
相关题目
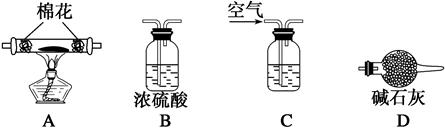
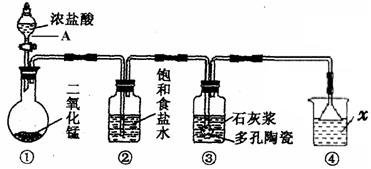
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O