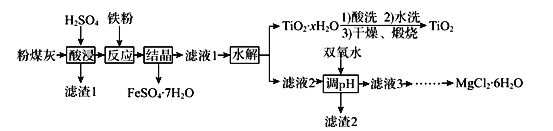
题目内容
【题目】NOx会造成大气污染,工业上采用多种方法进行处理。
I. 氯气氧化法:![]() 。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
II. 臭氧氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
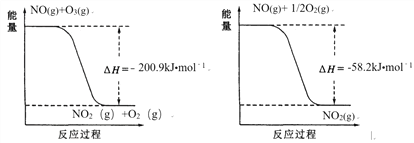
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 _______________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为_______________________________________。
(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:______________________________________。
III. 选择性非催化还原法:用同位素示踪法,在高温有氧下NH3做还原剂与 15NO 进行选择性反应。
请将该反应的化学方程式补充完整:____________________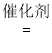 □15NN+□H2O
□15NN+□H2O
【答案】 0.05 增大 40 3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O
3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O ![]() HSO3- + OH- CaSO3浊液中存在:CaSO3(s)
HSO3- + OH- CaSO3浊液中存在:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快 4NH3 + 415NO + O2 4 6 (2分)
Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快 4NH3 + 415NO + O2 4 6 (2分)
【解析】I. 10min内v(ClNO)=0.005mol/(L·min),则平衡后n (ClNO)=0.005mol/(L·min) ![]() 10min
10min ![]() 2L=0.1mol,n(Cl2)=0.1mol-
2L=0.1mol,n(Cl2)=0.1mol-![]()
![]() 0.1mol=0.05mol;若其它条件不变,上述反应在恒压条件下进行,相当于与原来相比增大压强,平衡正向移动,则平衡时NO 的转化率增大,此条件下的平衡常数K值为
0.1mol=0.05mol;若其它条件不变,上述反应在恒压条件下进行,相当于与原来相比增大压强,平衡正向移动,则平衡时NO 的转化率增大,此条件下的平衡常数K值为![]() ;
;
II. (1)根据图中信息可知①NO(g) + O3(g)= NO2(g)+ O2(g) ΔH= -200.9 kJmol﹣1,②NO(g)+ ![]() O2(g)= NO2(g) ΔH= -58.2 kJmol﹣1,根据盖斯定律,由①+②
O2(g)= NO2(g) ΔH= -58.2 kJmol﹣1,根据盖斯定律,由①+②![]() 得反应3NO(g) + O3(g)
得反应3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1;(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,原因为亚硫酸根离子水解呈碱性SO32- + H2O
3NO2(g) ΔH= -317.3 kJmol﹣1;(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,原因为亚硫酸根离子水解呈碱性SO32- + H2O ![]() HSO3- + OH-;(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:CaSO3浊液中存在:CaSO3(s)
HSO3- + OH-;(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:CaSO3浊液中存在:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快;III.在高温有氧下NH3做还原剂与 15NO 进行选择性反应,生成15NN和H2O;反应的化学方程式补充完整为:4NH3 + 4span>15NO + O2
Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快;III.在高温有氧下NH3做还原剂与 15NO 进行选择性反应,生成15NN和H2O;反应的化学方程式补充完整为:4NH3 + 4span>15NO + O2 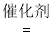 415NN+6H2O。
415NN+6H2O。

【题目】向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
实验编号 | 1 | 2 | 3 | 4 | 5 |
BaCl2溶液体/ mL | 0 | 30 | 60 | 100 | 120 |
沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
A. 混合前,BaCl2溶液的物质的量浓度为0.05 mol/L
B. 混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L
C. 实验3中沉淀的质量x为1.398g
D. 完全沉淀60mLNa2SO4溶液,消耗BaCl2溶液的体积为80mL