题目内容
甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应: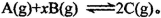 。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
下列说法正确的是
A.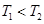 ,且该反应为吸热反应
,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.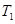 ℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
C
解析试题分析:A.对于甲、乙来说,起始投入量相同,而反应乙首先达到平衡说明温度T2>T1。在平衡时C(C)(乙) <C(C)(甲),说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热方向移动,逆反应方向是吸热反应,所以正反应是放热反应。错误。B.对乙、丙来说,反应的温度相同,而起始投入量丙是乙的2倍。在其它条件不变的情况下,若增加反应物的浓度,化学平衡不发生移动,则达到化学平衡时C(C)的浓度也应该是乙的2倍。现在2C(C)(乙)=C(C)(丙).说明改变反应物的浓度,化学平衡没有发生改变。只有在反应前后气体体积相等的可逆反应中,改变压强或改变浓度,化学平衡不移动。所以1+X=2,X=1.错误。C. 若平衡后保持温度不变,由于该反应是反应前后气体体积相等的可逆反应。改变容器体积,即改变压强,根据平衡移动原理,化学平衡不移动。正确。D.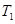 ℃下,起始时向甲容器中充入1.5molA、0.5molB,达到化学平衡时A的转化率为:(0.75÷1.5)×100%=50%.在该温度下,若起始时向甲容器中充入0.5molA、0.5molB,平衡时A的转化率为25%,然后再加入1molB,,增大反应物的浓度,平衡向正反应方向移动,故A的转化率就大于25%。错误。
℃下,起始时向甲容器中充入1.5molA、0.5molB,达到化学平衡时A的转化率为:(0.75÷1.5)×100%=50%.在该温度下,若起始时向甲容器中充入0.5molA、0.5molB,平衡时A的转化率为25%,然后再加入1molB,,增大反应物的浓度,平衡向正反应方向移动,故A的转化率就大于25%。错误。
考点:考查外加条件对化学平衡的影响的知识。

可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,P2>P1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
下列说法正确的是( )
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
| A.0~t2时,v正>v逆 |
| B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ |
| C.t2时刻改变的条件可以是向密闭容器中加C |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: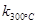 >
>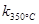 ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么 a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):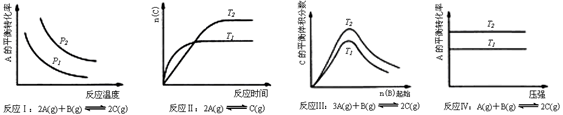
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ:△H>0,p2>p1 |
| B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D.反应Ⅳ:△H<0,T2>T1 |
下列不能用勒夏特列原理解释的是
| A.棕红色NO2加压后颜色先变深后变浅 |
| B.冰镇啤酒打开瓶塞后产生大量泡沫 |
| C.在H2,I2(g)和HI组成的平衡体系中加压后,混合物颜色加深 |
| D.Fe(SCN)3溶液中加入固体KSCN后颜色变化 |
已知298K时,2SO2(g)+O2(g)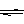 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是( )
| A.Q1=Q2=197KJ | B.Q1<Q2<197KJ | C.Q2<Q1<197KJ | D.Q1=Q2<197KJ |
 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( )
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( ) )
)