题目内容
12.“中东有石油,中国有稀土”、稀土是极其重要的战略资源.(1)萃取是分离稀土元素的常用方法.已知化合物W作为萃取剂能将铈离子从水溶液中萃取出来,W不能(填“能”或“不能”)与水互溶.实验室进行萃取操作时用到的主要玻璃仪器有分液漏斗、烧杯、玻璃棒、量筒等.
(2)铈(Ce)是地壳中含量最高的稀土元素.在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:2Ce3++1H2O2+6H2O═2Ce(OH)4↓+6H+.
(3)取上述处理后得到Ce(OH)4的产品0.6240g,加硫酸溶解后,用0.1mol•L-1 CeSO4标准溶液滴定终点时(铈被还原为Ce3+)消耗29.10ml标准溶液,该产品中Ce(OH)4的质量分数是97.00%.
分析 (1)根据萃取剂选择的原则及萃取实验用到的玻璃仪器解答;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,根据转移电子守恒、原子守恒配平方程式;
(3)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答 解:(1)根据萃取剂选择的原则可知萃取剂与水不互溶,所以W不能溶于水,萃取实验用到的玻璃仪器有:分液漏斗、烧杯、玻璃棒、量筒,所以还缺少的是分液漏斗;
故答案为:不能;分液漏斗;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,则O元素化合价由-1价变为-2价,转移电子数为2,根据电荷守恒知未知微粒是氢离子,根据转移电子守恒、原子守恒配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2,1,6H2O,2Ce(OH)4↓,6H+;
(3)根据电子守恒可得关系:Ce(OH)4~FeSO4,
0.6240g样品中含有Ce(OH)4的物质的量为:0.1000mol/L×0.02910L,
所以产品中Ce(OH)4的质量分数为:$\frac{0.1000mol/L×0.02910L}{0.624g}$×100%=97.00%;
故答案为:97.00%.
点评 本题为综合题,涉及萃取实验、氧化还原方程式配平、有关方程式计算,明确萃取实验过程及仪器,明确氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

练习册系列答案
相关题目
2.有5种短周期元素在周期表中位置如图所示.已知:X的氢化物可用于刻蚀普通玻璃.下列推断正确的是( )
| | | G | | X |
| R | T | Y |
| A. | R和Y组成的化合物水溶液呈中性 | |
| B. | 最高价氧化物的水化物酸性:Y>G>X>R | |
| C. | 简单氢化物稳定性:X>Y>T | |
| D. | 常温下,TX4、TY4都呈液态 |
3.下列有关元素锶(38Sr,ⅡA族)的叙述最不可能的是( )
| A. | 其氯化物是离子化合物 | B. | 其最高价氧化物水化物为一种弱碱 | ||
| C. | 它比Ca更易置换水中的氢 | D. | 它的碳酸盐难溶于水 |
20.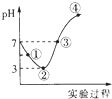 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ①处c(H+)约为②处c(H+)两倍 | |
| B. | 曲线③④段有离子反应:HClO+OH-═H2O+ClO- | |
| C. | 可以依据②处数据计算所得溶解的氯气的量n(Cl2) | |
| D. | ③处表示氯气与氢氧化钠恰好反应完全 |
7.短周期主要素X、Y、Z、W,在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
17.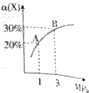 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
4.某有机物分子中含有一个C6H5-、一个-C6H4-、一个-CH2-、一个-OH,则该有机物属于酚类(-OH直接连在苯环上的物质属于酚类)的结构可能有( )
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
12.甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4mol A,乙中每分钟减少2mol A,则两容器中的反应速率( )
| A. | 甲快 | B. | 乙快 | C. | 相等 | D. | 无法确定 |
13.1mol某烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成四种不同的一氯取代物.该烃的结构简式是( )
| A. | 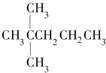 | B. | CH3CH2CH2CH2CH3 | C. | 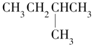 | D. | 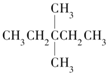 |