题目内容
燃烧1 g乙炔生成二氧化碳和液态水,放出热量50 kJ,则这一反应的热化学反应方程式为 ( )
| A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH="+50" kJ·mol-1 |
| B.C2H2(g)+5/2O2(g)====2CO2(g)+H2O;ΔH="-1" 300 kJ |
| C.2C2H2+5O2====4CO2+2H2O;ΔH="-2" 600 kJ |
| D.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH="-2" 600 kJ·mol-1 |
D
本题考查了热化学方程式的书写及简单计算。热化学方程式前面的化学计量数表示物质的量。反应热单位是kJ·mol-1,B和C均错。2 mol C2H2燃烧放出的热量为-2×26×50 kJ·mol-1="-2" 600 kJ·mol-1。

练习册系列答案
相关题目




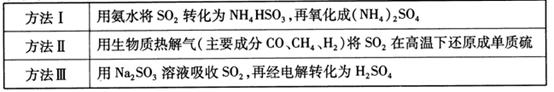
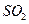 的化学反应为:
的化学反应为: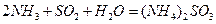
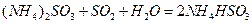
 . 通入空气使
. 通入空气使 转化为
转化为
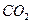 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。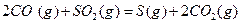
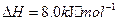
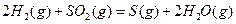
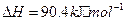
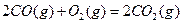
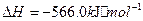
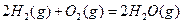
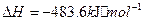
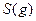 与
与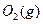 反应生成
反应生成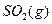 的热化学方程式为
的热化学方程式为  。
。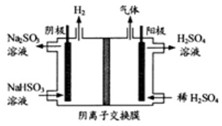
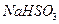 溶液的装置如上图所示。阳极区放出气体的成分为 。(填化学式)
溶液的装置如上图所示。阳极区放出气体的成分为 。(填化学式)