题目内容
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
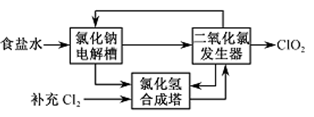
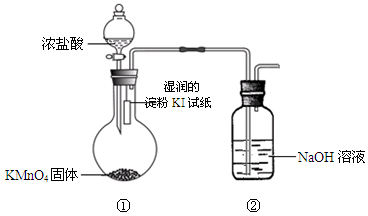
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】

②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
(1)①BaCl2
BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s)(或其它合理答案)
②H2、Cl2
2NaClO3 + 4HCl
 2ClO2↑ + Cl2↑ + 2NaCl + 2H2O
2ClO2↑ + Cl2↑ + 2NaCl + 2H2O(2)1C6H12O6+ 24 NaClO3 + 12H2SO4
 24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4
24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4(3)2.5
(1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去。根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+ CO32- (aq)= BaCO3(s)+SO42- (aq)。②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl。根据流程图可知加入物质为NaClO3和HCl,生成ClO2;可以写出方程式,并用化合价升降法配平得到。
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2。Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到。
(3)每摩尔Cl2得到2mol电子,而没摩尔ClO2得到5mol电子,故为2.5倍。
【考点定位】考查化学工艺流程,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目

 是两性氢氧化物,能溶于强酸或强碱。
是两性氢氧化物,能溶于强酸或强碱。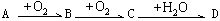 。以下推断不正确的是( )
。以下推断不正确的是( )