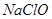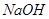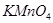题目内容
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中 有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),完成下列问题。
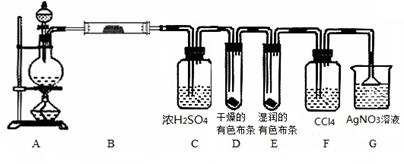
(1)用 MnO2和浓盐酸混合共热制得氯气的化学方程式是____ ____。
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积在标准状况下总是小于1.12 L的原因是_____________________________________________。
(3)①装置B的作用是____________________________________________________,
装置B中的现象是____________________________。
②装置D和E出现的不同现象说明的问题是_____________________________。
③装置F的作用是________________________。
④装置G中发生反应的化学方程式为 。

(1)用 MnO2和浓盐酸混合共热制得氯气的化学方程式是____ ____。
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积在标准状况下总是小于1.12 L的原因是_____________________________________________。
(3)①装置B的作用是____________________________________________________,
装置B中的现象是____________________________。
②装置D和E出现的不同现象说明的问题是_____________________________。
③装置F的作用是________________________。
④装置G中发生反应的化学方程式为 。
(1)MnO2+4HCl  MnCl2+Cl2↑+2H2O (2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生 无水硫酸铜变为蓝色
MnCl2+Cl2↑+2H2O (2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生 无水硫酸铜变为蓝色
②干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性 ③吸收氯气 ④HCl+AgNO3=AgCl↓+HNO3
 MnCl2+Cl2↑+2H2O (2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生 无水硫酸铜变为蓝色
MnCl2+Cl2↑+2H2O (2) 浓盐酸的浓度随着反应的进行降低到一定数值以后,将不再反应;加热时浓盐酸因挥发而损失。(3)①检验有水蒸气产生 无水硫酸铜变为蓝色②干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性 ③吸收氯气 ④HCl+AgNO3=AgCl↓+HNO3
试题分析:(1)在实验室是用MnO2和浓盐酸混合共热制得氯气的。化学方程式是MnO2+4HCl
 MnCl2+Cl2↑+2H2O(2)MnO2只和浓盐酸反应,但随着反应的进行,盐酸的浓度减小,当降低到一定程度时就不再发生反应。此外浓盐酸有挥发性,加热使盐酸因挥发而损失降低。所以放出的气体小于理论值1.12 L(3)①装置B的作用是用无水硫酸铜来检验氯气中水蒸气的存在。②干燥的氯气没有漂白性,当氯气中含有水蒸气时二者发生反应产生盐酸和次氯酸。次氯酸有漂白性。即潮湿的氯气(或次氯酸)有漂白性。③卤素单质容易溶解在有机溶剂中,而不容易溶解在水中。氯化氢则溶液溶解在水中,不易溶解在有机溶剂中。利用它们溶解性的不同,用四氯化碳来溶解吸收氯气。④HCl和AgNO3反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3
MnCl2+Cl2↑+2H2O(2)MnO2只和浓盐酸反应,但随着反应的进行,盐酸的浓度减小,当降低到一定程度时就不再发生反应。此外浓盐酸有挥发性,加热使盐酸因挥发而损失降低。所以放出的气体小于理论值1.12 L(3)①装置B的作用是用无水硫酸铜来检验氯气中水蒸气的存在。②干燥的氯气没有漂白性,当氯气中含有水蒸气时二者发生反应产生盐酸和次氯酸。次氯酸有漂白性。即潮湿的氯气(或次氯酸)有漂白性。③卤素单质容易溶解在有机溶剂中,而不容易溶解在水中。氯化氢则溶液溶解在水中,不易溶解在有机溶剂中。利用它们溶解性的不同,用四氯化碳来溶解吸收氯气。④HCl和AgNO3反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 废气
废气