题目内容
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)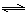 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)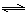 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g)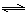 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)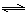 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)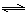 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)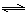 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
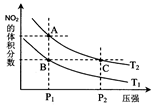
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
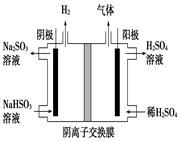
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
(1)已知C(s)+H2O(g)
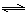 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。(2)已知在一定温度下,
C(s)+CO2(g)
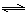 2CO(g) △H1
2CO(g) △H1CO(g)+H2O(g)
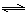 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2C(s)+H2O(g)
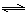 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3 则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)
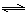 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)
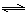 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。

(1)(共2分) 
(2)(共2分) △H3 =△H1+△H2 或△H1=△H3﹣△H2 或△H2 =△H3﹣△H1
(3)(共5分) 放热 (2分) 75% (3分)
(4)(共2分) E (不能选B,因为压强大过一倍以上时,压缩引起的颜色变化大过移动引起的颜色变化,所以C点比A点颜色深;温度相同,则平衡常数相同)
(5)(共4分) 4OH - - 4e-=2H2O+O2↑ (2分) O2、SO2 (2分)
(说明:阴离子放电顺序S2->I->Br->Cl->OH->含氧酸根(SO32->SO42->NO3-)>F- ;阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸性溶液)>Pb2+>Sn2+>Fe2+>Zn2+(>水解产生的H+)>Al3+>Mg2+>Na+>Ca2+>K+;溶液中电极电位:4OH—4e-=O2+2H2O E=﹣0.401 V;SO32-+2OH-=SO42-+H2O E=+0.90V。所以:在阴极是H+放电,在阳极是OH-放电不是SO32-;由于放电速度很快,离子移动速度较慢,阴极区OH-放电后多出的H+立即与SO32-反应放出SO2气体,阴极区多出的SO32-通过阴离子交换膜移动过阳极区补充)

(2)(共2分) △H3 =△H1+△H2 或△H1=△H3﹣△H2 或△H2 =△H3﹣△H1
(3)(共5分) 放热 (2分) 75% (3分)
(4)(共2分) E (不能选B,因为压强大过一倍以上时,压缩引起的颜色变化大过移动引起的颜色变化,所以C点比A点颜色深;温度相同,则平衡常数相同)
(5)(共4分) 4OH - - 4e-=2H2O+O2↑ (2分) O2、SO2 (2分)
(说明:阴离子放电顺序S2->I->Br->Cl->OH->含氧酸根(SO32->SO42->NO3-)>F- ;阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸性溶液)>Pb2+>Sn2+>Fe2+>Zn2+(>水解产生的H+)>Al3+>Mg2+>Na+>Ca2+>K+;溶液中电极电位:4OH—4e-=O2+2H2O E=﹣0.401 V;SO32-+2OH-=SO42-+H2O E=+0.90V。所以:在阴极是H+放电,在阳极是OH-放电不是SO32-;由于放电速度很快,离子移动速度较慢,阴极区OH-放电后多出的H+立即与SO32-反应放出SO2气体,阴极区多出的SO32-通过阴离子交换膜移动过阳极区补充)
试题分析:(1)由反应方程式可知C为固体,所以平衡常数的表达式为

(2)根据热化学方程式和盖斯定律得,方程式③=①+②,所以△H3=△H1 +△H2 。
(3)根据表格中数据可知,随着温度的升高,平衡常数逐渐减小,说明正反应进行的程度逐渐减小,所以平衡逆向移动,正反应为放热反应;500℃时,平衡常数K=9,所以有:
CO(g)+H2O(g)
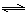 H2(g) + CO2(g),
H2(g) + CO2(g),初始浓度(mol/L) 0.020 0.020 0 0
转化浓度(mol/L) 0.02α 0.02α 0.02α 0.02α
平衡浓度(mol/L) 0.02(1-α) 0.02(1-α) 0.02α 0.02α
所以代入表达式中K=(0.02α)2/ [0.02(1-α)]2 =9,解得α=75%,所以CO转化率为75%。
(4)图为不同温度下平衡体系中的NO2体积分数随压强变化曲线图,所以分析:
A:反应速率受温度、浓度、压强等因素影响,C点的压强远大于A,压强越大反应速率越大,C>A,A错误。
B:NO2为红棕色,颜色深浅与浓度大小有关, C点对于A点,增大了压强,平衡逆向移动,NO2减少,但是因为C点压强远大于A点,所以被压缩后浓度增大要大于平衡移动造成的浓度减小,所以C的颜色深,A浅,B错误。
C:B、C两点在不同条件控制下平衡时NO2的体积分数相等,所以气体的总质量和总物质的量相等,平均相对分子质量相等B=C,C项错误。
D:正反应为吸热反应,升高温度平衡正向移动,NO2的体积分数增大,所以加热不能实现状态A到状态B的转化,D项错误。
E:A、C两点在同一温度线上,所以温度相同平衡常数相同,A=C,所以E正确。
故选E。
(5)根据如图电解装置可知,阴极HSO3-电离出的H+在阴极区得到电子被还原生成了H2阴极反应式:2H++2e-=H2↑,而阳极区水电离的OH-先放电,失去电子生成O2,阳极反应式:4OH - - 4e-=2H2O+O2↑,由于阳极区不断消耗OH-,所以使得阴极区产生的SO32- 不断通过阴离子交换膜,并与阳极溶液中的H+反应2H++ SO32- =SO2↑+H2O,所以阳极区有氧气产生,也有SO2产生。而通过离子交换膜的部分SO32- 也会被生成的氧气氧化生成SO42- ,所以也会不断生成硫酸产品。(说明:阴离子放电顺序S2->I->Br->Cl->OH->含氧酸根(SO32->SO42->NO3-)>F- ;阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸性溶液)>Pb2+>Sn2+>Fe2+>Zn2+(>水解产生的H+)>Al3+>Mg2+>Na+>Ca2+>K+;溶液中电极电位:4OH—4e-=O2+2H2O E=﹣0.401 V;SO32-+2OH-=SO42-+H2O E=+0.90V。所以:在阴极是H+放电,在阳极是OH-放电不是SO32-;由于放电速度很快,离子移动速度较慢,阴极区OH-放电后多出的H+立即与SO32-反应放出SO2气体,阴极区多出的SO32-通过阴离子交换膜移动过阳极区补充)

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。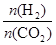 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。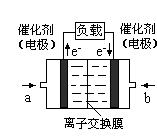
 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1

 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol