题目内容
某澄清溶液X中可能含有大量Cl 、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:

则下列说法中正确的是
 、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
则下列说法中正确的是
| A.现象3不能证明X中是否含有SO42— |
| B.现象2气体C中至少有一种是CO2或SO2,操作Ⅰ为过滤 |
C.现象5表明X溶液中一定含有Cl |
| D.现象1表明X溶液显酸性,沉淀D为Fe(OH)3 |
D
试题分析:根据题意知,某澄清溶液X中加入紫色石蕊,溶液变红色,说明X溶液呈酸性,溶液中一定不含SO32—,Fe2+、Fe3+至少存在一种;向其中加入过量硝酸钡溶液,生成的白色沉淀A一定为硫酸钡,溶液中一定含有SO42—,气体C为Fe2+与氢离子、硝酸根发生氧化还原反应生成的一氧化氮,原溶液一定含有Fe2+,溶液B中一定含有Fe3+;加入过量氢氧化钠溶液,过滤,得沉淀D为氢氧化铁,无色溶液E中含有过量的氢氧根,加入足量硝酸银溶液,生成白色沉淀F可能是氢氧化银或氯化银和氢氧化银的混合物。由上述分析知,A、现象3能证明X中一定含有SO42—,错误;B、现象2气体C中是氮的氧化物,操作Ⅰ为过滤,错误;C、现象5表明X溶液中不一定含有Cl
 ,错误;D、现象1表明X溶液显酸性,沉淀D为Fe(OH)3,正确。
,错误;D、现象1表明X溶液显酸性,沉淀D为Fe(OH)3,正确。
练习册系列答案
相关题目



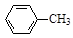 + 2KMnO4
+ 2KMnO4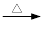
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O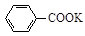 + HCl
+ HCl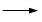
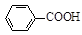 +KCl
+KCl
 Na2S2O3(aq)
Na2S2O3(aq)