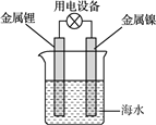
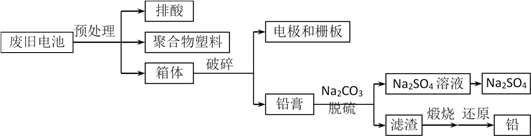
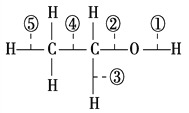
题目内容
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
【答案】 2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol CO32- + H2O ![]() HCO3- + OH- c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 0.01 2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑ 5 6
HCO3- + OH- c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 0.01 2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑ 5 6
【解析】(1)CO的燃烧热为akJ/mol,CO完全燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+ ![]() O2(g)=CO2(g) △H=-akJ/mol,故答案为:2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+
O2(g)=CO2(g) △H=-akJ/mol,故答案为:2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+ ![]() O2(g)=CO2(g) △H=-akJ/mol;
O2(g)=CO2(g) △H=-akJ/mol;
(2)Na2CO3溶液中CO32-水解,CO32-+H2O![]() HCO3-+OH-,使Na2CO3溶液呈碱性,故答案为:CO32-+H2O
HCO3-+OH-,使Na2CO3溶液呈碱性,故答案为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)Na2CO3溶液中存在的CO32-水解,且以第一步水解为主,溶液中存在的离子有:H+、Na+、OH-、HCO3-、CO32-,电荷守恒关系为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);
(4)Na2CO3溶液中存在物料守恒c(Na+)=2c(HCO3-)+2c(CO32-)+ 2c(H2CO3),则c(CO32-)+c(HCO3-)+c(H2CO3)= ![]() c(Na+)=0.01mol/L×2×
c(Na+)=0.01mol/L×2×![]() =0.01mol/L,故答案为:0.01;
=0.01mol/L,故答案为:0.01;
(5)向碳酸钠溶液中滴加AlCl3溶液,发生双水解反应,有二氧化碳和氢氧化铝沉淀生成,反应的离子方程式为2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑;
(6)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,则c(OH-)=![]() mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,故答案为:5;
mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,故答案为:5;
(7)使0.2molL-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-4mol/L,则c(OH-)=![]() mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6。
mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6。

【题目】将等量的CO(g)和H2O(g)分别通入到容积为2 L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下列数据:
CO2(g)+H2(g),得到下列数据:
实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 2 | 4 | 0.9 | t |
①在实验1中,以v(CO2)表示该反应前5分钟的平均反应速率为________; __________;平衡时的压强和反应开始的压强之比为__________。
②在实验2中,t________5(填“大于”“小于”或“等于”)。