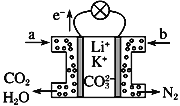
题目内容
【题目】Fe、A1、Cu是生活中常用的金属。
(1)基态Cu原子核外电子排布式为_____________,基态Fe2+核外有_________个未成对电子。
(2)①re、Al、Cu三种元素第一电离能由高到低的顺序为___________________。
②Mn和Fe的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/kJ mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_____________。
(3)铁可形成多种配合物,如[Fe(CN)6]4-、Fe(CO)5等,lmol Fe(CN)43-中含有σ键的数目为________;Fe(CO)5熔点为-20.5℃,沸点为103℃:易溶于CCl4,据此可以判断Fe(CO)3晶体属于________ (填晶体类型)。
(4)下列变化过程中,破坏的力的作用类型相同的是_____________;(填字母代号)。
A.铝气化 B.A1C13溶于水 C.加热使铜熔化 D.熔融NaC1
(5)Fe能与N形成一种磁性材料,其晶胞结构如图所示:

①该磁性材料的化学式为__________________;
②Fe原子的坐标参数为(![]() ,
, ![]() ,0)、(
,0)、(![]() ,0,
,0, ![]() )、________、(0,0,0),N原子的坐标参数为_______。
)、________、(0,0,0),N原子的坐标参数为_______。
③已知该晶体的晶胞参数α pm,列出其密度表达式为_________g cm-3(用含α的式子表示,只列式子,不作计算。)。
【答案】 [Ar]3d104s1 4 Cu、Fe、Al Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转交为不稳定的3d4状态(或Fe2+较化为Fe3+时,3d能级由不稳定的3d6状态转交为较稳定的3d5半充满状态) 12NA 分子晶体 AC Fe4N (0, ![]() ,
, ![]() ) 【答题空10】(
) 【答题空10】(![]() ,
, ![]() ,
, ![]() ) 238/〔NA×(a×10-10)3〕
) 238/〔NA×(a×10-10)3〕
【解析】(1)Cu是29号元素,核外有29个电子,故核外电子排布式为[Ar]3d104s1;基态Fe2+核外电子排布为1s22s22p63s23p63d6,故未成对电子数目为4个;(2)①根据三种金属活泼性:Cu<Fe<Al,结合核外电子排布情况:Cu的核外价电子中3d全满,4s半满,第一电离能最大,Al的核外价电子3p上有一个单电子,故第一电离能最小;②Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;(3)每分子Fe(CN)62-中有6条配位键(是δ键),每个CN-配体中有1个δ键,故共12条δ键,Fe(CO)5的熔沸点较低,易溶于非极性溶剂,故判断其为分子晶体;(4)铝气化、加热使铜熔化都破坏金属键;AlCl3溶于水破坏共价键,熔融NaCl破坏离子键;(5)①该晶胞中N原子个数为1,Fe原子个数=8×![]() +6×
+6×![]() =4,故其化学式为Fe4N;②Fe原子位于晶胞的顶点(8个顶点等效)和面心(6个面心,两两相对的面心是等效的,相当于有3个不同位置),因此原子坐标参数共有4个,顶点:(0,0,0),面心:(
=4,故其化学式为Fe4N;②Fe原子位于晶胞的顶点(8个顶点等效)和面心(6个面心,两两相对的面心是等效的,相当于有3个不同位置),因此原子坐标参数共有4个,顶点:(0,0,0),面心:(![]() ,
, ![]() ,0)、(
,0)、(![]() , 0,
, 0, ![]() )、(0,
)、(0, ![]() ,
, ![]() )。N原子在体心,原子坐标参数为(
)。N原子在体心,原子坐标参数为(![]() ,
, ![]() ,
, ![]() );③晶胞中相当于含有1个Fe4N,其密度为ρ=
);③晶胞中相当于含有1个Fe4N,其密度为ρ=![]() =
=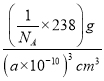 =
=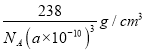 。
。

 名校课堂系列答案
名校课堂系列答案【题目】下列各项中,对所描述内容的相关分析不正确的是
选项 | 描述 | 分析 |
A | “青蒿一握,以水二升渍,绞取计” | 其中涉及到了萃取过程 |
B | 炼丹家制硫酸时用“炼石胆(胆矾)取其精华” | 其中利用了分解反应 |
C | 古代染坊常用某种碱剂来精炼丝绸 | 碱剂不可能为烧碱 |
D | “古剑‘沈卢’,以剂钢为刃” | 剂钢的成分为纯铁 |
A. A B. B C. C D. D