题目内容
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
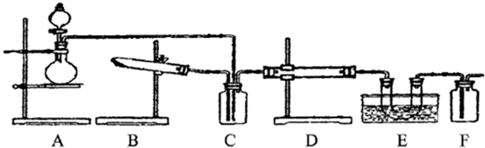
I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
(3)本实验在设计上有无缺失之处?若有请答出改进方案
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理

I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
,C装置中盛放的液体药品的名称是浓硫酸
浓硫酸
.(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
C中两导管口气泡的产生速率
C中两导管口气泡的产生速率
得知.(3)本实验在设计上有无缺失之处?若有请答出改进方案
有,应在EF之间连接一个防倒吸装置
有,应在EF之间连接一个防倒吸装置
;(若无,此问可不答)II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
| ||
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
.
| ||
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基 本一致,那么C处的广口瓶应改为U形管或干燥管
U形管或干燥管
,所装药品为碱石灰(其他合理答案亦可)
碱石灰(其他合理答案亦可)
.分析:(1)V2O5作催化剂时,是二氧化硫转化为三氧化硫时的反应条件,二氧化硫可以用浓硫酸来干燥;
(2)根据C装置的作用来回答;
(3)F装置进行尾气处理时,易导致倒吸现象的产生;
(4)铂铑合金网作催化剂,是氨气的催化氧化时的反应条件;
(5)可以用浓氨水和固体NaOH(或生石灰或碱石灰)混合不加热的方法来制氨气;
(6)将氨气干燥需用碱石灰,固体干燥剂放在干燥管中.
(2)根据C装置的作用来回答;
(3)F装置进行尾气处理时,易导致倒吸现象的产生;
(4)铂铑合金网作催化剂,是氨气的催化氧化时的反应条件;
(5)可以用浓氨水和固体NaOH(或生石灰或碱石灰)混合不加热的方法来制氨气;
(6)将氨气干燥需用碱石灰,固体干燥剂放在干燥管中.
解答:解:(1)V2O5作催化剂时,是二氧化硫转化为三氧化硫时的反应条件,所以A是制取二氧化硫的装置,所发生的反应的化学方程式是:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;干燥二氧化硫用浓硫酸,
故答案为::Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;浓硫酸;
(2)C装置的作用:干燥二氧化硫;调节二氧化硫和氧气的混合比例;可控制二氧化硫和氧气的产生速率,欲知二氧化硫和氧气在D中的通入量,可通过观察C中两导管口气泡的产生速率来判断,故答案为:C中两导管口气泡的产生速率;
(3)F装置进行尾气处理时,易导致倒吸现象的产生,所以应在EF之间连接一个防倒吸装置,故答案为:有,应在EF之间连接一个防倒吸装置;
(4)铂铑合金网作催化剂,是氨气的催化氧化时的反应条件,所以D装置是氨气的催化氧化反应,其发生反应的化学方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以);
(5)可以用浓氨水和固体NaOH(或生石灰或碱石灰)混合不加热的方法来制氨气,其原理是:化学平衡NH3+H2O?NH3?H2O?NH4++OH-的移动原理,故答案为:将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出;
(6)氨气是碱性气体,需用碱石灰干燥氨气,固体干燥剂放在干燥管中,故答案为:U形管或干燥管,碱石灰(其他合理答案亦可).
故答案为::Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;浓硫酸;
(2)C装置的作用:干燥二氧化硫;调节二氧化硫和氧气的混合比例;可控制二氧化硫和氧气的产生速率,欲知二氧化硫和氧气在D中的通入量,可通过观察C中两导管口气泡的产生速率来判断,故答案为:C中两导管口气泡的产生速率;
(3)F装置进行尾气处理时,易导致倒吸现象的产生,所以应在EF之间连接一个防倒吸装置,故答案为:有,应在EF之间连接一个防倒吸装置;
(4)铂铑合金网作催化剂,是氨气的催化氧化时的反应条件,所以D装置是氨气的催化氧化反应,其发生反应的化学方程式为:4NH3+5O2
| ||
| ||
(5)可以用浓氨水和固体NaOH(或生石灰或碱石灰)混合不加热的方法来制氨气,其原理是:化学平衡NH3+H2O?NH3?H2O?NH4++OH-的移动原理,故答案为:将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出;
(6)氨气是碱性气体,需用碱石灰干燥氨气,固体干燥剂放在干燥管中,故答案为:U形管或干燥管,碱石灰(其他合理答案亦可).
点评:本题重点考查氨气的性质,以实验题的形式出现,综合性较强,难度较大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
(15分)某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取。
① Na2CO3② NaOH ③ Ca(OH)2④ NaHCO3⑤ NH4Cl
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯。部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)A中发生的化学反应方程式为________。制取气体所用到的玻璃仪器主要有_______种(不包括连接装置)。
(2)B装置的作用为____________________________。 (3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
(3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:_______________________________________________________。
②通过计算说明这次碰撞是弹性碰撞还是非弹性碰撞。




 (3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
(3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)