题目内容
8.化学用语是学习化学的重要工具,下列化学用语中正确的是( )| A. | 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e-═4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO${\;}_{3}^{-}$+H2O═CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 将Na2CO3在水溶液加热蒸干,由于CO2易挥发,最终得到NaOH固体 |
分析 A.负极失去电子发生氧化反应;
B.碳酸氢根水解生成碳酸和氢氧根;
C.硫化汞溶解度小于硫化亚铁,实现沉淀的转化;
D.碱性环境下不能生成酸性气体.
解答 解:A.氢氧燃料电池在碱性介质中负极的反应式是:H2+2OH--2e-═2H2O,故A错误;
B.NaHCO3在水溶液中的水解离子方程式,离子方程式:HCO3-+H2O?H2CO3+OH-,故B错误;
C.用FeS为沉淀剂除去废水中的Hg2+,离子方程式:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq),故C正确;
D.将Na2CO3在水溶液加热蒸干,仍然得到碳酸钠,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意盐类水解的应用、注意书写燃料电池电极反应式应考虑电解质性质,题目难度不大.

练习册系列答案
相关题目
18.某有机物的结构简式如图.下列关于该有机物的叙述正确的是( )
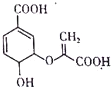

| A. | 分子中含有3种官能团 | |
| B. | 遇FeCl3溶液呈现为紫色 | |
| C. | 1mol该物质最多可与2molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
19.关于NO的下列叙述不正确的是( )
| A. | NO不溶于水,是一种大气污染物 | |
| B. | NO是一种红棕色的有毒气体 | |
| C. | NO结合血红蛋白的能力比CO还强 | |
| D. | NO与氧气反应生成NO2,体现其还原性 |
16.下列说法正确的是( )
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=一123.8 KJ/mol |
13.辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势.回答下列问题:
(1)钼位于第五周期VIB族.与钼相邻的上一周期同族元素的符号为Cr;该元素基态原子的电子最后排布的能级为3d,该能级上总的电子数为5.
(2)碳和硫有关数据如表:
①由上述数据可以得出,碳元素的非金属性比硫弱(填“强”或“弱”).
②写出能证明该结论的化学方程式H2SO4+Na2CO3=Na2SO4+CO2↑+H2O.
(3)从不同角度观察MoS2的晶体结构如图1,2,根据MoS2的晶体结构回答:
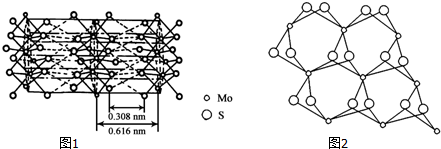
①钼的配位数为6.
②Mo与S之间的化学键为AC(填序号).
A.极性键 B.非极性键 C.配位键 D.金属键 E.范德华力
③辉钼纳米粒子的润滑性能非常优异,其原因是MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动.
(4)硅与碳在高温下反应可得到金刚砂(SiC),其结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得的金刚砂(SiC)结构.如果我们以一个硅原子为中心,设SiC晶体中硅原子与其最近的碳原子的最近距离为d,则与硅原子次近的第二层有12个原子,其离中心原子的距离是$\frac{2\sqrt{6}}{3}$d.
(1)钼位于第五周期VIB族.与钼相邻的上一周期同族元素的符号为Cr;该元素基态原子的电子最后排布的能级为3d,该能级上总的电子数为5.
(2)碳和硫有关数据如表:
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
②写出能证明该结论的化学方程式H2SO4+Na2CO3=Na2SO4+CO2↑+H2O.
(3)从不同角度观察MoS2的晶体结构如图1,2,根据MoS2的晶体结构回答:

①钼的配位数为6.
②Mo与S之间的化学键为AC(填序号).
A.极性键 B.非极性键 C.配位键 D.金属键 E.范德华力
③辉钼纳米粒子的润滑性能非常优异,其原因是MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动.
(4)硅与碳在高温下反应可得到金刚砂(SiC),其结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得的金刚砂(SiC)结构.如果我们以一个硅原子为中心,设SiC晶体中硅原子与其最近的碳原子的最近距离为d,则与硅原子次近的第二层有12个原子,其离中心原子的距离是$\frac{2\sqrt{6}}{3}$d.
20.下列实验目的可以实现或操作正确的是( )
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
17.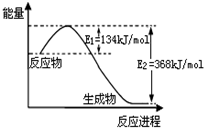 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
(1)一定温度下,在2L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为20%.
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,写出该反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol
(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②试判断K1>K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol 则NH3 (g)的燃烧热282.8kJ/mol.
(4)常温1L0.1mol•L-1醋酸与1L0.1mol•L-1氨水反应,放出的热量为a kJ,写出此离子反应的热化学方程式CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在2L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为20%.
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,写出该反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol
(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol 则NH3 (g)的燃烧热282.8kJ/mol.
(4)常温1L0.1mol•L-1醋酸与1L0.1mol•L-1氨水反应,放出的热量为a kJ,写出此离子反应的热化学方程式CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.
18.下列说法或表示方法正确的是( )
| A. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol |