题目内容
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为______.
(2)当氨碳比
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2)______B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).
②NH3的平衡转化率为______.
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为______(填“A”或“B”).
②阳极室中发生的反应依次为______、______.
③电解结束后,阴极室溶液的pH与电解前相比将______;若两极共收集到气体13.44L(标准状况),则除去的尿素为______g(忽略气体的溶解).
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为______.
(2)当氨碳比
| n(NH3) |
| n(CO2) |
①A点的逆反应速率v逆(CO2)______B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).
②NH3的平衡转化率为______.
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为______(填“A”或“B”).
②阳极室中发生的反应依次为______、______.
③电解结束后,阴极室溶液的pH与电解前相比将______;若两极共收集到气体13.44L(标准状况),则除去的尿素为______g(忽略气体的溶解).
(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:
2NH3+CO2
CO(NH2)2+H2O,故答案为:2NH3+CO2
CO(NH2)2+H2O;
(2)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为
×100%=30%,
故答案为:30%;
(3)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源
的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
③阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)
阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44L气体,物质的量为
=0.6mol,即n(N2)=n(CO2)=0.6mol×
=0.12mol,
根据方程式CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60g?mol-1=7.2g,
故答案为:不变,7.2;
2NH3+CO2
| ||
| ||
(2)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为
| 1.2a |
| 4a |
故答案为:30%;
(3)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源
的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
③阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)
阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44L气体,物质的量为
| 13.44L |
| 22.4/mol |
| 1 |
| 5 |
根据方程式CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60g?mol-1=7.2g,
故答案为:不变,7.2;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )
2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )
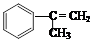 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下: