题目内容
【题目】柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3 +C6H8O7=FeC6H6O7+CO2↑+H2O
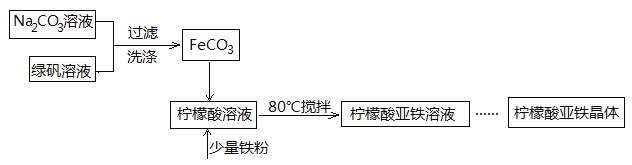
(1)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
(2)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_________________。
②反应结束后,无需过滤,除去过量铁粉的方法是_____________。
(3)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________。
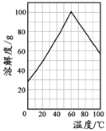
(4)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
①向一定量烧渣中加入足量的稀硫酸充分反应,过滤
②向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体
③向固体中加入足量稀硫酸至固体完全溶解
④再加入足量的铁粉,充分搅拌后,过滤得到FeSO4 溶液
⑤_______________________________________________,得到FeSO4·7H2O 晶体。
(5)取25.00g柠檬酸亚铁晶体(摩尔质量为246g/mol),配成100mL溶液,取20.00mL至锥形瓶中,另取0.2000mol.L-1的酸性KMnO4标准溶液装入酸式滴定管中,用氧化还原法测定柠檬酸亚铁晶体的质量分数,杂质不与酸性KMnO4标准溶液反应,经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
滴定终点时现象为:__________________________________柠檬酸亚铁的质量分数________________
【答案】 取最后一次洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 防止+2的铁元素被氧化 加入适量柠檬酸,让铁粉反应完全 降低柠檬酸亚铁在水中的溶解量,有利于晶体析出 加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤 用少量冰水洗涤,低温干燥 锥形瓶内溶液颜色变为紫色,且半分钟内不恢复原来颜色 98.40%
【解析】(1)本题中FeCO3的制备是用Na2CO3溶液和FeSO4溶液的反应,因而沉淀表面可能会有Na2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,即该题便转化成SO42-的检验。
(2)①因+2的Fe元素易被空气中的氧气氧化,制备柠檬酸亚铁过程中应尽量避免与氧气接触。
②除去过量的铁粉可直接加入适量的柠檬酸,反应也生成了需要的产品柠檬酸亚铁,不会引入杂质。
(3)加入无水乙醇,可以降低柠檬酸亚铁的溶解度,从而获得更多的产品。
(4)根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,进行分析解答。
(5)当酸性KMnO4标准溶液与亚铁离子反应结束后,锥形瓶内溶液颜色变为紫色,且半分钟内不恢复原来颜色,达到滴定终点;根据反应关系Fe2+→Fe3+,MnO4-→Mn2+可知,根据电子守恒规律:5Fe2+---MnO4-,计算出柠檬酸亚铁晶体的质量,最后计算柠檬酸亚铁晶体的纯度。
(1)本题中FeCO3的制备是用Na2CO3溶液和FeSO4溶液的反应,因而沉淀表面可能会有Na2SO4杂质,因而应该检验最后一次洗涤滤液中是否含有SO42-,即该题便转化成SO42-的检验;具体操作如下:取最后一次洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;正确答案:取最后一次洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(2)①因+2的Fe元素易被空气中的氧气氧化,制备柠檬酸亚铁过程中应尽量避免与氧气接触;加入铁粉的目的就是与柠檬酸反应产生H2,形成一个无氧的环境;正确答案:防止+2价的铁元素被氧化。
②除去过量的铁粉可直接加入适量的柠檬酸,反应也生成了需要的产品柠檬酸亚铁,不会引入杂质。正确答案:加入适量柠檬酸让铁粉反应完全。
(3)最后的溶液经浓缩形成柠檬酸亚铁的饱和溶液,要得到尽可能多的柠檬酸亚铁晶体,可加入无水乙醇,可以降低柠檬酸亚铁的溶解度,从而获得更多的产品;正确答案:降低柠檬酸亚铁在水中的溶解量,有利于晶体析出。
(4)⑤根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,再根据绿矾溶解度曲线,60℃时绿矾的溶解度最大,可加热浓缩到60℃的饱和溶液,然后放在冰水中冷却,冷却结晶至0℃,此时析出的晶体是最多的,之后过滤,洗涤,低温烘干,所以操作a为加热到60℃浓缩、冷却结晶、过滤,用少量冰水洗涤,低温干燥;正确答案:加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,用少量冰水洗涤,低温干燥 。
(5)酸性KMnO4标准溶液滴定柠檬酸亚铁晶体,发生反应紫色溶液褪去,当锥形瓶内溶液颜色变为紫色,且半分钟内不恢复原来颜色,达到滴定终点;根据反应关系Fe2+→Fe3+,MnO4-→Mn2+可知,根据电子守恒规律:5Fe2+---MnO4-,由于第3次数据误差较大,不能用;根据1,2,4三组数据可知,消耗KMnO4溶液体积为20 mL,所以消耗MnO4-的量为0.2×20×10-3=4×10-3mol,则消耗的亚铁离子的量为5×4×10-3mol,则柠檬酸亚铁晶体的量为5×4×10-3mol×100/20=0.1 mol,柠檬酸亚铁晶体的质量为0.1×246=24.6g,柠檬酸亚铁的质量分数24.6/25×100%=98.40%;正确答案:锥形瓶内溶液颜色变为紫色,且半分钟内不恢复原来颜色;98.40%。