��Ŀ����
����Ŀ��2007��ȫ����ʯ�ͼ۸�Ӹ߲��£�����Ҫԭ����������������ķ�չ���˿����࣬����Դ���������������ӣ�ȫ��ʯ�ʹ����½���Ѱ����Ʊ����ų����ڽ���������Դ�Ѿ���Ϊ��������ѧ�����������о�����Ȼ���ʹ���ϳ��������͵ķ�����
��֪����1������ȩ��ֱ��������̼ԭ���ϵ����Ϊ��һHԭ�ӣ���ϡ����Һ�Ĵ������£�һ��ȩ�����ϵ���һHԭ�����ӵ���һ��ȩ���ӵ���ԭ���ϣ����ಿ�����ӵ��ʻ�̼ԭ���������ǻ�ȩ���磺
��1��R-CH2-CHO+R1-CH2-CHO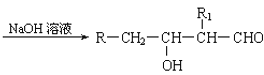
��2��2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
��3��CH3-CH=CH2+H-Cl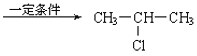
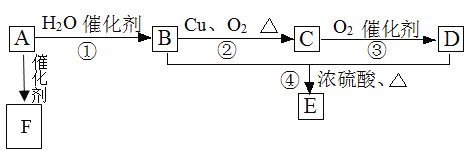
�ϳ�·�����£�
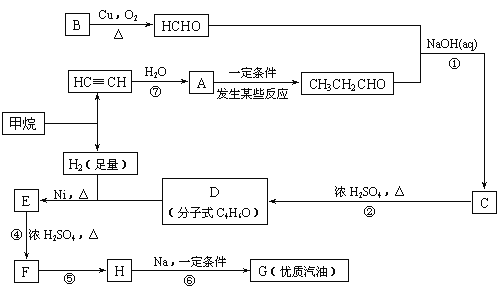
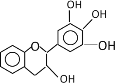
��1��д��D�Ľṹ��ʽ___��
��2���ڷ�Ӧ�ڡ����У����ڼӳɷ�Ӧ����___��������ȥ��Ӧ����___��
��3��д����Ӧ����ʽ��E��F��___��
��4��HҲ����NaOHˮ��Һ��Ӧ���䷴Ӧ����ʽΪ___��
���𰸡�CH2=C(CH3)CHO �ۢݢ� �ڢ� (CH3)2CHCH2OH ![]() (CH3)2C=CH2 +H2O
(CH3)2C=CH2 +H2O 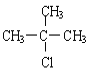 +NaOH
+NaOH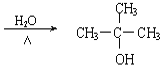 +NaCl
+NaCl
��������
�ɺϳ�·�߿�֪��BΪCH3OH����Ӧ��ΪCH��CH��ˮ�ļӳɷ�Ӧ����AΪCH2=CHOH��CH3CHO�������Ϣ��֪��HCHO��CH3CH2CHO������Ӧ��Ϊ�ӳɷ�Ӧ����CΪCH2OHCH(CH3)CHO����Ӧ��Ϊ��ȥ��Ӧ����DΪCH2=C(CH3)CHO��D�������ӳ�����E����EΪ(CH3)2CHCH2OH����Ӧ��Ϊ��ȥ��Ӧ������FΪ(CH3)2C=CH2����Ӧ��ΪF��HCl�ļӳɷ�Ӧ������HΪ(CH3)3CCl����Ӧ��Ϊȡ����Ӧ����GΪ(CH3)3CC(CH3)3��Ȼ�����л���Ľṹ�����������
(1)������������֪��DΪCH2=C(CH3)CHO���ʴ�Ϊ��CH2=C(CH3)CHO��
(2)������������֪����Ӧ�ڡ����У�D��E�ķ�Ӧ��Ϊ�ӳɣ�F��H�ķ�Ӧ��Ϊ�ӳɣ���Ӧ��ΪCH��CH��ˮ�ļӳɷ�Ӧ��C��D�ķ�Ӧ��Ϊ��ȥ��Ӧ��E��F�ķ�Ӧ��Ϊ��ȥ��Ӧ���ʴ�Ϊ���ۢݢߣ��ڢܣ�
(3)EΪ(CH3)2CHCH2OH��FΪ��E����FΪ�ǻ�����ȥ��Ӧ������ʽΪ��(CH3)2CHCH2OH ![]() (CH3)2C=CH2 +H2O��
(CH3)2C=CH2 +H2O��
(4)HΪ(CH3)3CCl������������ˮ��Һ�з���ȡ����Ӧ������ʽΪ��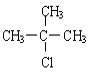 +NaOH
+NaOH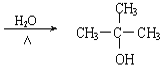 +NaCl��
+NaCl��

����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��2��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ___�档
����Ŀ����.�ⶨ��ѧ��Ӧ����
ijͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�
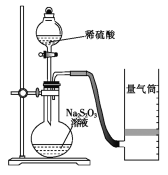
(��֪��S2O32-+2H+=H2O+S��+SO2��)
��1��Ϊ��֤ʵ��ȷ�ԡ��ɿ��ԣ����ø�װ�ý���ʵ��ǰӦ�Ƚ��еIJ�����__������ͼ��ʾ��ʵ����Ʒ�������⣬����Ҫ��һ��ʵ��������__��
��2������2minʱ�ռ���224mL(������ɱ�״��)���壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����___��
��.Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ������
ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족����֪��5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������ѡ�Լ���������0.20mol/LH2C2O4��Һ��0.010mol/L����KMnO4��Һ������ˮ����ƿ������ˮԡ�ۣ���Ͳ���������С����������µķ�����
������ | ˮ | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
���/mL | Ũ��/molL-1 | ���/mL | Ũ��/molL-1 | ���/mL | ||
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 1.0 | 0.010 | 4.0 | 25 | ||
��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪ��n(H2C2O4)��n(KMnO4)��__��
��2��ʵ��۲��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v��KMnO4��=__mol��L-1��min-1��
��3������ɱ����ڶ����հ�__��__��
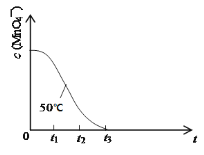
��4����֪50��ʱc(MnO4-)����Ӧʱ��t�ı仯������ͼ�����з�Ӧ�������Ľ���__��ԭ����___��