题目内容
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
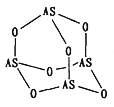
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
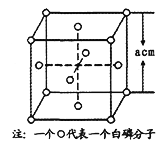
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
【答案】 高 NH3分子间存在较强的氢键,而PH3分子间仅有范德华力 离子键、共价键 正四面体 sp3 sp2 平面三角形 SO3、CO32- BC 16 ![]()
【解析】(1)NH3和PH3都属于分子晶体,都存在范德华力,但由于NH3分子间存在氢键,导致NH3的沸点比PH3高。答案为:高、NH3分子间存在较强的氢键,而PH3分子间仅有范德华力
(2)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=![]() ,价层电子对数为4+0=4,据此判断空间构型为正四面体;As4O6的分子中As原子形成3个AsO键,含有1对孤对电子,杂化轨道数目为4,所以杂化类型为sp3杂化;答案为:离子键、共价键,正四面体 ,sp3
,价层电子对数为4+0=4,据此判断空间构型为正四面体;As4O6的分子中As原子形成3个AsO键,含有1对孤对电子,杂化轨道数目为4,所以杂化类型为sp3杂化;答案为:离子键、共价键,正四面体 ,sp3
(3)①硝酸根中N原子价电子层电子为3对,理想模型为平面三角形,没有孤电子对,其杂化方式为sp2杂化;与硝酸根为等电子体的物质为:SO3、CO32-等
②A. 判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:同种元素化合价越高,含氧酸中氧原子总数越多酸性越强,A中没有指明同一种元素,所以A错误;B. 同种元素化合价越高,含氧酸中氧原子总数越多酸性越强,B正确;C.HNO3中氮元素化合价更高,得到电子能力强,所以相较HNO2酸性更强,C正确。所以选择BC。答案为:①sp2 、平面三角形、 SO3或CO32- ②BC
(4)根据均摊法可知,晶胞中P4分子数目为8×![]() +6×
+6× ![]() = 4,则晶胞中P原子数目为4×4=16,晶胞质量为16×
= 4,则晶胞中P原子数目为4×4=16,晶胞质量为16×![]() g,晶胞体积为(acm)3,则晶胞密度为:
g,晶胞体积为(acm)3,则晶胞密度为:![]() =
=![]() =
=![]() =
=![]() g·cm-3
g·cm-3
故答案为:16 、 ![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号 | 事实 | 推论 |
A | S(s)+H2(g)=H2S(g) ΔH <0 Se(s)+H2(g)=H2Se(g) ΔH >0 | 非金属性:S >Se |
B | Li在O2中点燃生成Li2O 而Na在O2中点燃生成Na2O2 | 金属性:Na >Li |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2 + H2 I2 + H2 | 非金属性:Br > I |
A. A B. B C. C D. D