题目内容
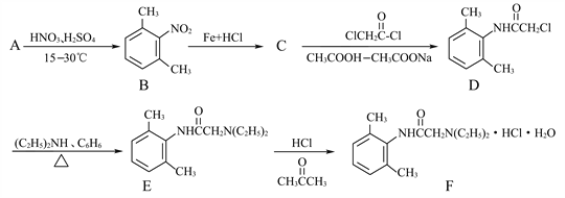
【题目】已知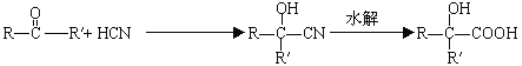 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)写出下列有机物的结构简式:
A___________________C _______________________E ____________________F_________________。
(2)写出下列有关反应的化学方程式:
C →D_______________________;
D →E_______________________;
E→F_______________________。
【答案】 ![]()
![]() CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3 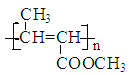
![]()
![]() CH3CH=CH-COOH+H2O CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O n CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O n CH3-CH=CHCOOCH3![]()
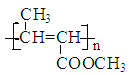
【解析】已知 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)根据A生成B的条件结合信息和E没有支链可知,A发生信息中反应生成 B,根据A的分子式可知,A为CH3CH2CHO,A与HCN发生加成反应生成B为CH3CH2CHOHCN,B水解得C为CH3CH2CHOHCOOH,C在浓硫酸作用下加热发生消去反应得D为CH3CH=CHCOOH,D发生酯化反应生成E,E为CH3CH=CHCOOCH3,E发生加聚反应得F为 。综上所述,A为CH3CH2CHO,C为CH3CH2CHOHCOOH,E为CH3CH=CHCOOCH3,F为
。综上所述,A为CH3CH2CHO,C为CH3CH2CHOHCOOH,E为CH3CH=CHCOOCH3,F为 ,故答案为:CH3CH2CHO;CH3CH2CHOHCOOH;CH3CH=CHCOOCH3;
,故答案为:CH3CH2CHO;CH3CH2CHOHCOOH;CH3CH=CHCOOCH3; ;
;
(2)C →D的化学方程式为![]()
![]() CH3CH=CH-COOH+H2O;D →E的化学方程式为CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O;D →E的化学方程式为CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O;E→F的化学方程式为CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O;E→F的化学方程式为CH3-CH=CHCOOCH3![]()
 ;故答案为:
;故答案为:![]()
![]() CH3CH=CH-COOH+H2O;CH3CH=CH-COOH+CH3OH
CH3CH=CH-COOH+H2O;CH3CH=CH-COOH+CH3OH![]() CH3-CH=CHCOOCH3+H2O;n CH3-CH=CHCOOCH3
CH3-CH=CHCOOCH3+H2O;n CH3-CH=CHCOOCH3![]()
 。
。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大