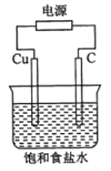
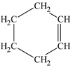
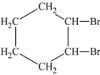
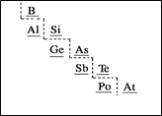
题目内容
【题目】Ⅰ.氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。
(1)该反应中氧化剂是____________ ,氧化产物是____________。用单线桥表示反应的电子转移__________________。
(2)从反应可以看出氧化性:Cl2___________N2(填“>” “<”“=” )。若71g氯气参与反应,理论上生成N2的体积(标准状况)为_________________L(保留小数点后一位)。工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成的白烟的化学式______________。
Ⅱ.实验室现需配制100 mL 0.1mol/L的氢氧化钠溶液,请将步骤补充完整
计算可得需要氢氧化钠的质量为_____________ g。
将称量好的固体放入小烧杯中,加适量蒸馏水溶解;
将所得溶液冷却至室温后,沿玻璃棒小心转入100 mL_________(填仪器名称)
用少量蒸馏水烧杯2~3次,每次洗涤液都转入容量瓶中;
继续加蒸馏水至液面距刻度线1~2cm处,改用____________小心滴加蒸馏水至刻度线处;摇匀;装瓶,贴标签。
【答案】Cl2 N2 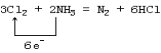 > 7.5 NH3+HCl=NH4Cl 0.4g 容量瓶 胶头滴管
> 7.5 NH3+HCl=NH4Cl 0.4g 容量瓶 胶头滴管
【解析】
Ⅰ. 由方程式可知,反应中Cl元素化合价降低被还原,Cl2为氧化剂,N元素化合价升高被氧化,NH3为还原剂,过量NH3可与HCl反应生成氯化铵,有白烟生成;
Ⅱ.配制100 mL 0.1mol/L的氢氧化钠溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀。
Ⅰ.(1)由方程式可知,反应中Cl元素化合价降低被还原,Cl2为氧化剂,N元素化合价升高被氧化,N2是氧化产物,生成1molN2时有6mol电子转移,用单线桥表示反应的电子转移如下: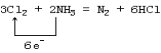 ,故答案为:Cl2;N2;
,故答案为:Cl2;N2;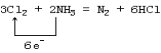 ;
;
(2)由氧化剂的氧化性强于氧化产物可知,氯气的氧化性强于氮气;由方程式可得如下关系:3Cl2—N2,则71g氯气参与反应生成标准状况下N2的体积为![]() ×
×![]() ×22.4L/mol≈7.5L;当NH3过量时,过量NH3可与HCl反应生成氯化铵,有白烟生成,反应的化学方程式为NH3+HCl=NH4Cl,故答案为:>;7.5;NH3+HCl=NH4Cl;
×22.4L/mol≈7.5L;当NH3过量时,过量NH3可与HCl反应生成氯化铵,有白烟生成,反应的化学方程式为NH3+HCl=NH4Cl,故答案为:>;7.5;NH3+HCl=NH4Cl;
Ⅱ. 100 mL 0.1mol/L氢氧化钠溶液中含有的氢氧化钠的物质的量为1mol/L×0.1L=0.1mol,则氢氧化钠的质量为40g/mol×0.1mol=4.0g;将所得溶液冷却至室温后,沿玻璃棒小心转入100 mL容量瓶中,并用玻璃棒引流;加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故答案为:4.0;容量瓶;胶头滴管。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。

①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。